
(14分)下图所示物质(部分产物和反应条件未标出)中,只有A是单质,常温下B和C呈气态,且B是导致酸雨的大气污染物,W是淡黄色固体。
据此回答下列问题:
(1)物质W中所含有的化学键类型为 ,其阴、阳离子个数比为 。
(2)物质C的结构式为 。
(3)上图反应中不属于氧化还原反应的有 (填写序号)。
(4)写出A和X反应的化学方程式 ;若生成的B在标准状况下的体积为22.4L,则反应中转移电子数目为 。
(5)请写出C和W反应的化学方程式: 。
(6)请写出X和 Y反应的离子方程式: 。
科目:高中化学 来源: 题型:阅读理解
物质 | 熔点( ℃) | 沸点( ℃) | 密度(g·cm-3) |
乙醇 | -117.0 | 78.0 | 0.79 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) | —— | 338.0 | 1.84 |
学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液。
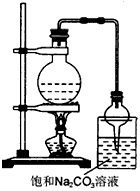
②按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5—10 min。
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层。
④分离出乙酸乙酯层,洗涤、干燥。
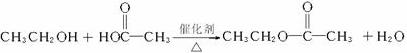
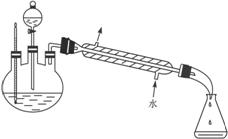
图1 图2
请根据题目要求完成下列问题:
(1)配制该混合溶液的主要操作步骤为:___________________________________________;
写出制取乙酸乙酯的化学方程式:________________________________________________。
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):_______________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是:_______________________________。
(4)指出步骤③所观察到的现象:_____________________________;分离出乙酸乙酯层后,一般用饱和食盐水和饱和氯化钙溶液洗涤,可通过洗涤除去(填名称)_____________ 等杂质;为了干燥乙酸乙酯可选用的干燥剂为(填字母):_____________。
A.P2O5 B.无水Na2SO4 C.碱石 D.NaOH固体
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与图1装置相比,图2装置的主要优点有:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)氮的氧化物(用NOx表示)是大气污染物,必须加以处理。
(1)汽车尾气中的CO、NOx采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。反应化学方程式可表示为:______________。
(2)工业尾气中氮的氧化物常采用氨催化吸收法,原理是NH3和NOx反应生成无毒的物质。某同学采用以下装置(见下图)和步骤模拟工业上氮的氧化物处理过程。
Ⅰ.提供的装置。
Ⅱ.NH3的制取。
①所提供的装置中能快速、简便制取NH3的装置是:__________(填仪器序号)。
②若采用C装置制取氨气(控制实验条件相同),情况如表所示。
实验记录
| 试剂组合序号 | 固体试剂/g | NH3体积/mL |
| a | 12.0g Ca(OH)2(过量) 10.8g NH4Cl | 2688 |
| b | 12.0g Ca (OH)2(过量) 10.8g(NH4)2SO4 | 2728 |
| c | 12.0g NaOH(过量) 10.8g NH4Cl | 3136 |
| d | 12.0g NaOH(过量) 10.8g (NH4)2SO4 | 3118 |
| e | 12.0g CaO(过量) 10.8g NH4Cl | 3506 |
| f | 12.0g CaO(过量) 10.8g (NH4)2SO4 | 3584 |
分析表中数据,实验室制NH3产率最高的是:___________________(填序号),其他组合NH3产率不高的原因是:____________。
Ⅲ.模拟尾气的处理。
选用上述部分装置,按下列顺序连接成模拟尾气处理装置:
①A中反应的离子方程式:_________。
②D装置作用除使气体混合均匀和调节气流速度以外,还有一个作用是_____________。
③D装置中的液体可换成_________(填序号)。
a.CuSO4溶液 b.H2O c.CCl4 d.浓H2SO4
④该同学所设计的模拟尾气处理实验还存在的明显缺陷是________________。
查看答案和解析>>
科目:高中化学 来源:2012年人教版高中化学必修二3.3 生活中两种常见的有机物练习卷(解析版) 题型:实验题
已知下列数据:
|
物质 |
熔点(℃) |
沸点(℃) |
密度(g/cm3) |
|
乙醇 |
-117.3 |
78.5 |
0.789 |
|
乙酸 |
16.6 |
117.9 |
1.05 |
|
乙酸乙酯 |
-83.6 |
77.5 |
0.90 |
|
浓硫酸(98%) |
- |
338.0 |
1.84 |
学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
②按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10 min;
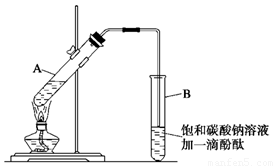
③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层,洗涤、干燥。
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为____________________________________
写出制取乙酸乙酯的化学方程式: _____________________________________
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)_______________________________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是____________________________________
(4)指出步骤③所观察到的现象: _______________________________________________
分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)__________。
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体
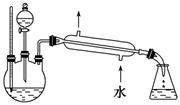
(5)某化学课外小组设计了如下图所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与上图装置相比,此装置的主要优点有: __________________________________
查看答案和解析>>
科目:高中化学 来源:0104 模拟题 题型:填空题
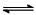 O2+Hb·CO 实验表明,c(Hb·CO)即使只有c(Hb·O2)的1/50,也可造成人的智力损伤。已知t℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2mol·L-1,若使c(Hb·CO)小于c(Hb·O2)的1/50,则吸入肺部CO的浓度不能超过_________mol·L-1。
O2+Hb·CO 实验表明,c(Hb·CO)即使只有c(Hb·O2)的1/50,也可造成人的智力损伤。已知t℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2mol·L-1,若使c(Hb·CO)小于c(Hb·O2)的1/50,则吸入肺部CO的浓度不能超过_________mol·L-1。 N2(g) + 2CO2(g) △H=-113kJ·mol-1
N2(g) + 2CO2(g) △H=-113kJ·mol-1
 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表: 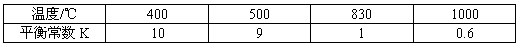

查看答案和解析>>
科目:高中化学 来源:江苏模拟题 题型:实验题
 CH3COOC2H5 + H2O
CH3COOC2H5 + H2O 

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com