
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为5NA | |
| C. | 1 mol甲基的电子数目为7NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其所含原子总数为3NA |
分析 A、标况下戊烷为液体;
B、求出乙烯的物质的量,然后根据1mol乙烯中含6mol共用电子对来分析;
C、甲基不显电性;
D、乙烯、丙烯和丁烯的最简式均为CH2.
解答 解:A、标况下戊烷为液体,故不能根据气体摩尔体积来计算其物质的量和分子数,故A错误;
B、28g乙烯的物质的量为1mol,而1mol乙烯中含6mol共用电子对,即含6NA对,故B错误;
C、甲基不显电性,故1mol甲基中含9NA个电子,故C错误;
D、乙烯、丙烯和丁烯的最简式均为CH2,故14g混合物中含有的CH2的物质的量为n=$\frac{14g}{14g/mol}$=1mol,故含3NA个原子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
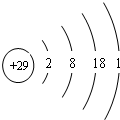
| 元素 | 结构或性质信息 |
| X | 其原子最外层电子数是内层电子数的2倍 |
| Y | 基态原子最外层电子排布为nsnnpn+1 |
| Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
| M | 单质在常温、常压下是气体.基态原子的M层上有1个未成对的p电子 |
| Q | 其与X形成的合金为目前用量最多的金属材料 |
 .
.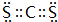 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

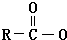 Na+NaOH$→_{△}^{CaO}$R-H+Na2CO3
Na+NaOH$→_{△}^{CaO}$R-H+Na2CO3 ,K的结构简式为
,K的结构简式为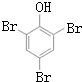 .
.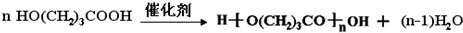 ;
;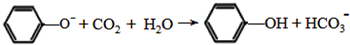 .
. (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,同周期从左到右原子半径从小到大(稀有气体除外)发生周期性变化 | |
| C. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| D. | 元素原子核外电子排布的周期性变化是导致原子半径、元素主要化合价和元素性质周期性变化的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2分子间存在着非极性共价键 | |
| B. | CO2分子内存在着极性共价键 | |
| C. | SO2与H2O反应的产物是离子化合物 | |
| D. | 盐酸中含有H+和Cl-,故HCl为离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从左向右数第七纵行是ⅦA族 | |
| B. | 从左向右数第十一纵行是ⅠB族 | |
| C. | ⅠA族全部是金属元素 | |
| D. | 第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上电解饱和食盐水的阳极反应为:2Cl--2e-═Cl2↑ | |
| B. | 船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁吸氧腐蚀的正极反应为:O2+2H2O+4e-═4OH- | |
| D. | 铁表面镀锌,铁作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极为Fe、负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为Ag、负极为Fe,电解质溶液为CuSO4溶液 | |
| C. | 正极为Fe、负极为Zn,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为C、负极为Fe,电解质溶液为Fe(NO3)3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com