
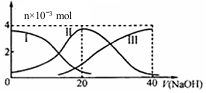
 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HAˉ,III代表A2ˉ).根据图判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HAˉ,III代表A2ˉ).根据图判断,下列说法正确的是( )| A. | 当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(A2-)>c(H+)>c(HA-)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大 | |
| C. | 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+3c(H2A)+c(HA-)=c(A2-)+2c(OH-) | |
| D. | 向NaHA溶液加入水的过程中,pH可能增大也可能减小 |
分析 A.根据图象知,当V(NaOH)=20时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,电离为主,溶液显酸性;
B.酸或碱抑制水电离,含有弱根离子的盐水解促进水电离;
C.当V(NaOH)=30mL时,发生反应为NaOH+H2A=NaHA+H2O,NaHA+NaOH=Na2A+H2O,溶液主要为等物质量的NaHA,Na2A的混合溶液,根据电荷守恒和物料守恒;
D.NaHA溶液中加水稀释,存在HA-电离和水解,根据图象可知,NaHA溶液显示酸性,向NaHA溶液加入水的过程中,其电离程度增大,但是溶液中氢离子浓度减小,溶液的pH一定增大.
解答 解:A.当V(NaOH)=20 mL时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,HA-电离大于水解,溶液显酸性,则c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故A错误;
B.由图示关系知,c(A2-)>c(H2A),说明电离大于水解程度,溶液显酸性,水的电离受到了抑制,故B错误;
C.当V(NaOH)=30mL时,发生反应为NaOH+H2A=NaHA+H2O,NaHA+NaOH=Na2A+H2O,溶液主要为等物质量的NaHA,Na2A的混合溶液,根据电荷守恒得:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-)①,物料守恒可知:3c(HA-)+3c(A2-)+3c(H2A)=2c(Na+)②,①×2+②得:2c(H+)+c(HA-)+3c(H2A)═c(A2-)+2c(OH-),故C正确;
D.NaHA溶液加入水的过程中,HA-电离程度增大,但是溶液中氢离子浓度减小,溶液的pH增大,故D错误;
故选C.
点评 本题考查酸碱混合溶液定性判断、溶液中离子浓度大小比较,题目难度中等,试题侧重于学生的分析能力的考查,为高考常见题型,明确图象中酸碱混合时溶液中的溶质成分是解答本题的关键,抓住图象进行分析即可.


科目:高中化学 来源: 题型:选择题
| A. | 2.8g | B. | 5.6g | C. | 8.4g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
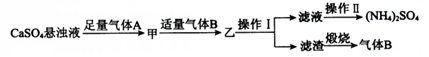
| A. | 气体B是NH3,可循环利用 | |
| B. | 操作Ⅰ中,所用的主要玻璃仪器为烧杯、玻璃棒、分液漏斗 | |
| C. | 操作Ⅱ中,可用蒸发结晶的方法得到纯净的(NH4)2SO4 | |
| D. | 整个过程的总反应方程式为CaSO4+CO2+2NH3+H2O═CaCO3↓+(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径由小到大的顺序:X<Y<Z<W | |
| B. | Z的最高价氧化物对应的水化物为弱酸 | |
| C. | 在一定条件下,与Y同主族的短周期元素某单质可以与氧化铁发生置换反应 | |
| D. | 常温下,0.1mol•L-1 W的氢化物水溶液的pH>1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 证明浓度的改变可导致平衡移动:将少量KCl晶体加入FeCl3+3KSC?Fe(SCN)3+3KCl的平衡体系中 | |
| B. | 除去MgCl2溶液中少量的FeCl3:向含有少量FeCl3的MgCl2溶液中加入足量的Mg(OH)2粉末,搅拌一段时间后过滤 | |
| C. | 检验某溶液中是否含有乙醛:向盛有2mL 10%CuSO4溶液的试管中滴加0.5mL10%NaOH溶液,混合均匀,滴入待检液,加热 | |
| D. | 证明Fe3+的氧化性大于I2:将KI溶液和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置,下层溶液显紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 配制100mL1.0mol/LCuSO4溶液 | 将25g CuSO4•5H2O溶于100mL蒸馏水中 |
| B | 除去CuO中混有的Al2O3 | 加入过量NaOH溶液后,过滤、洗涤、干燥 |
| C | 证明氧化性:H2O2>Fe3+ | 强硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
| D | 证明非金属性:Cl>C | 向NaHCO3溶液中加入过量盐酸振荡、静置、观察 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴被称为“海洋元素” | B. | 硅酸钠可作建筑行业的黏合剂 | ||
| C. | 碳酸钠可作治疗胃酸过多的药剂 | D. | 镁可用于制造信号和焰火 |
查看答案和解析>>
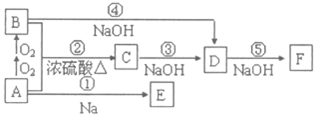
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>Z>X | |
| B. | X、Y、Z都能与W组成离子化合物 | |
| C. | X、Y组成的化合物可与W单质反应 | |
| D. | Q是Z、W组成的化合物,1molQ中约含有6.02×1023个阴离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com