
| A. | 导电性强的溶液一定是强电解质溶液 | |
| B. | NaCl晶体由Na+和Cl-组成,NaCl晶体是电的良导体 | |
| C. | H2SO4是强电解质,稀硫酸中没有H2SO4分子 | |
| D. | pH=3是醋酸稀释至100倍,pH=5 |
分析 A.电解质强弱取决于电离程度;
B.物质导电的条件是含有自由电子或者自由移动的离子;
C.强电解质完全电离;
D.醋酸为弱酸,稀释过程中电离程度增大.
解答 解:A.电解质强弱取决于电离程度,与导电性强弱无关,故A错误;
B.氯化钠晶体中不含有自由移动的离子,不能导电,故B错误;
C.强电解质完全电离,不含有分子,H2SO4是强电解质,稀硫酸中没有H2SO4分子,故C正确;
D.醋酸为弱酸,稀释过程中电离程度增大,所以pH=3是醋酸稀释至100倍,pH小于5,故D错误;
故选:C.
点评 本题考查了电解质的强弱及性质,明确电解质强弱概念及电离特点是解题关键,注意影响弱电解质电离平衡的因素,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
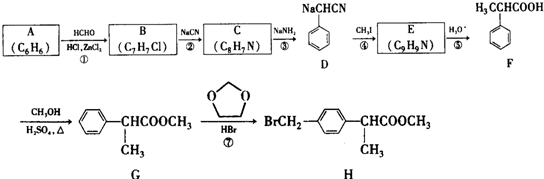
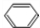 +HCHO+HCl$\stackrel{ZnCl_{2}}{→}$
+HCHO+HCl$\stackrel{ZnCl_{2}}{→}$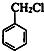 +H2O.
+H2O.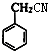 ;E的结构简式为
;E的结构简式为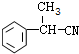 .
. .
.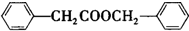 的合成路线
的合成路线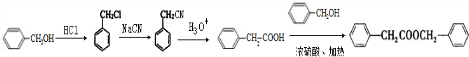 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 中和热的测定实验(如图).
中和热的测定实验(如图).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有第2列元素的原子最外层有2个电子 | |
| B. | 第14列元素形成化合物种类最多 | |
| C. | 第3列元素种类最多 | |
| D. | 第17、18列元素都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制容器可长期存放碱性食物 | B. | 水玻璃浸泡过的木材能防腐 | ||
| C. | 过氧化钠用作呼吸面具中的供氧剂 | D. | 氯气用于农药的生产和药物合成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用Zn和稀硫酸制H2,为加快反应速率,可向稀硫酸中加入少量Cu粉 | |
| B. | CH3Cl(g)+Cl2(g)$\stackrel{光照}{→}$CH2Cl2(l)+HCl(g)常温下能自发进行,则该反应的△H>0 | |
| C. | 在一体积可变的恒温密闭容器中发生反应PCl3(g)+Cl2(g)?PCl5(g),压缩体积,平衡正向移动,K值增大 | |
| D. | 25℃时Ka(HClO)=3.0×10-8,Ka(HCN)=4.9×10-10,若该温度下NaClO溶液与NaCN溶液pH相同,则c(NaClO)<c(NaCN) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com