
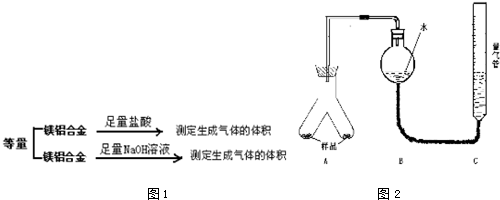
分析 (1)实验目的是通过测量气体体积计算合金中镁的质量分数,所以必须确保装置气密性良好;可以向C中进入少量水,根据液面变化判断装置气密性;
(2)合金是否完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积)等会影响测定结果;
(3)镁、铝都与稀硫酸反应,二者生成氢气总体积为V2-V1,据此计算出氢气的物质的量,然后分别根据合金质量、生成氢气的量列式计算出二者的物质的量,再计算出镁的质量及质量分数;
(4)镁不与氢氧化钠溶液反应,可以根据生成的氢气计算出铝的物质的量,再计算出铝的质量分数,从而可以得出合金中镁的质量分数,所以可以省略③.
解答 解:(1)分析流程和步骤可知,该实验目的是通过测定气体体积的方法测定合金质量分数,故装置需要气密性完好,应对装置进行气密性检查,检查方法为:向C中加入一定量水,然后提高C使其中液面高于B,静置一会儿,若液面不发生变化则气密性良好;
故答案为:检查气密性;向C中加入一定量水,然后提高C使其中液面高于B,静置一会儿,若液面不发生变化则气密性良好;
(2)为使该实验方案测定结果尽可能准确,则必须保证合金完全溶解(或加入足量盐酸),还要调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等,
故答案为:合金完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等合理答案);
(3)每份合金的质量a=0.30g,根据题中信息可知,进入足量稀硫酸后镁、铝都与稀硫酸反应,生成氢气总体积为:448mL-112mL=336mL,生成气体的物质的量为:$\frac{0.336L}{22.4L/mol}$=0.015mol,设镁的物质的量为x、铝的物质的量为y,则24x+27y=0.3、x+1.5y=0.015mol,解得:y=$\frac{0.02}{3}$mol、x=0.005mol,则合金中镁的质量为:24g/mol×0.005mol=0.12g,则合金中镁的质量分数为:$\frac{0.12g}{0.3g}$×100%=40%,
故答案为:40%;
(4)步骤④中的氢气为铝与氢氧化钠溶液反应生成的,可以根据氢气的体积计算出氢气的物质的量,然后计算出铝的物质的量、质量,从而得出合金中镁的质量及质量分数,所以可省略③,
故答案为:合理,合金中只有铝与氢氧化钠溶液反应,可以根据④中生成的氢气的量计算出铝的量,从而计算出镁的质量分数.
点评 本题考查了探究物质组成及含量的方法,题目难度中等,明确探究原理为解答关键,注意掌握常见的化学实验基本操作方法,试题侧重考查学生的分析、理解能力及化学实验、化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| C. | Fe (NO3)2与HI的反应:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| D. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素X、Y、Z、W、E、Q在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21.回答下列问题
短周期元素X、Y、Z、W、E、Q在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21.回答下列问题| X | Y | Z | W |
| E | Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | E(4s)>E(3p)>E(3d) | B. | E(3s)>E(3p)>E(3d) | C. | E(6s)>E(4f)>E(5d) | D. | E(5s)>E(4p)>E(3d) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当n(Na)=n(Mg)=n(Al)=1mol时,①成立 | B. | 当n(Na)=n(Mg)=n(Al)=0.8mol时,②成立 | ||
| C. | 当n(Na)=n(Mg)=n(Al)=0.6mol时,③成立 | D. | 当n(Na)=n(Mg)=n(Al)=0.5mol时,④成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | NH3•H2O | C. | CuO | D. | BaCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com