
 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置. CH3COOC2H5+H2O,生成的乙酸乙酯的密度小于水的密度,有果香气味,
CH3COOC2H5+H2O,生成的乙酸乙酯的密度小于水的密度,有果香气味,

科目:高中化学 来源: 题型:
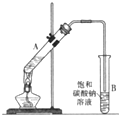 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.| 乙酸 | 乙醇 | 乙酸乙酯 | 乙醚 | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 与水混溶 | 与乙醚混溶 | 微溶于水 |
| 浓硫酸 |
| 140℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某实验小组欲制取乙酸乙酯,设计了如下图所示的装置,请回答有关问题:
某实验小组欲制取乙酸乙酯,设计了如下图所示的装置,请回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
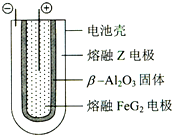 有X、Y、Z、M、G五种元素,是分属三个短周期并且原子序数依次增大的主族元素.其中X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.完成下列填空:
有X、Y、Z、M、G五种元素,是分属三个短周期并且原子序数依次增大的主族元素.其中X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.完成下列填空:| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 6 4 2 3 8 |
| B、2 4 3 2 2 6 |
| C、2 0 1 2 0 2 |
| D、2 2 2 2 1 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
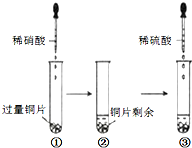 某实验过程如图所示,则图③试管中的现象是( )
某实验过程如图所示,则图③试管中的现象是( )| A、铜片溶解,产生无色气体,该气体遇空气变为红棕色 |
| B、铜片溶解,产生无色气体,该气体遇到空气不变色 |
| C、铜片溶解,放出红棕色有刺激性气味的气体 |
| D、无明显现象,因稀硫酸不与铜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙醛中的乙酸杂质:加入氢氧化钠溶液洗涤,分液 |
| B、检验乙醇中是否含水:用无水硫酸铜,观察是否变蓝色 |
| C、鉴别SO2和Cl2:通入品红溶液,观察是否褪色 |
| D、获得NH4Cl晶体:将NH4Cl溶液蒸发浓缩,冷却结晶,过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com