
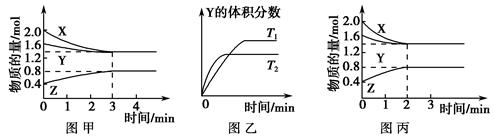
A���÷�Ӧ�ɱ�ʾΪ3X(g)��Y(g) 2Z(g) 2Z(g) |
| B���������������䣬�����¶ȣ�ƽ�⽫���淴Ӧ�����ƶ� |
| C���������������䣬��ʼʱ��������ѹ��Ϊ1 L����Ӧ����ͼ������ |
| D���������������䣬ʹ���ʵ��Ĵ�������Ӧ����ͼ������ |
 ��һ����ͬ���ɽ�����ϵ�д�
��һ����ͬ���ɽ�����ϵ�д� ������Ӧ���ϵ�д�
������Ӧ���ϵ�д� ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO2��H2��724��ﵽƽ��ʱ���ֱ�ı�����������Kֵ�����仯����
CO2��H2��724��ﵽƽ��ʱ���ֱ�ı�����������Kֵ�����仯����| A����ѹǿ��С��ԭ����һ�� | B������Ӧ�¶����� |
| C�����Ӵ��� | D������ˮ������Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 WI2(g) (I)���÷�Ӧ��ʯӢ��չ��н��У�����ͼ��ʾ��
WI2(g) (I)���÷�Ӧ��ʯӢ��չ��н��У�����ͼ��ʾ��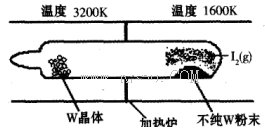
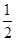 ����ij�����ܱ������м���1mol I2(g)������W(s)����Ӧ�ﵽƽ��ʱI2(g)��ת����Ϊ__________��
����ij�����ܱ������м���1mol I2(g)������W(s)����Ӧ�ﵽƽ��ʱI2(g)��ת����Ϊ__________�� HSO3����H���ĵ��볣��Ka��____mol/L������H2SO3��Һ�м���������I2������Һ��
HSO3����H���ĵ��볣��Ka��____mol/L������H2SO3��Һ�м���������I2������Һ��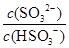 ��________�����������С�����䡱����
��________�����������С�����䡱����| n(SO32��): n ( HSO3��) | 91:9 | 1:1 | 1:91 |
| pH(25��) | 8.2 | 7.2 | 6.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 pC(g)�ﵽƽ��ʱ�����c(A)Ϊ0.5 mol��L-1�����¶Ȳ���������£��������������һ�������ﵽƽ��ʱ�����c(A)Ϊ0.3 mol��L-1���������ж���ȷ����( )
pC(g)�ﵽƽ��ʱ�����c(A)Ϊ0.5 mol��L-1�����¶Ȳ���������£��������������һ�������ﵽƽ��ʱ�����c(A)Ϊ0.3 mol��L-1���������ж���ȷ����( )�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���μ�AgNO3��Һ,�л�ɫ�������� |
| B������CCl4��,�²�Һ��Ϊdz��ɫ |
| C������CCl4��,�²�Һ��Ϊdz��ɫ;ȡ�ϲ���Һ,�μ�AgNO3��Һ,�а�ɫ�������� |
| D������CCl4��,�²�Һ��Ϊdz��ɫ;ȡ�ϲ���Һ,�μ�KSCN��Һ,��Һ�Ժ�ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO2(g)+H2(g) ��H<0��
CO2(g)+H2(g) ��H<0��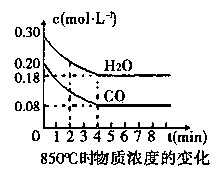
| ʱ��(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO2(g)+NO(g) ��H��0�����¶�t1ʱ�ﵽƽ�⣬c1(CO)=c1(NO2)=1��0 mol��L-1����ƽ�ⳣ��ΪK1�������������䣬���߷�Ӧ��ϵ���¶���t2ʱ����Ӧ���ƽ��Ũ�ȷֱ�Ϊc2(CO)��c2(NO2)��ƽ�ⳣ��ΪK2����
CO2(g)+NO(g) ��H��0�����¶�t1ʱ�ﵽƽ�⣬c1(CO)=c1(NO2)=1��0 mol��L-1����ƽ�ⳣ��ΪK1�������������䣬���߷�Ӧ��ϵ���¶���t2ʱ����Ӧ���ƽ��Ũ�ȷֱ�Ϊc2(CO)��c2(NO2)��ƽ�ⳣ��ΪK2����| A��������COŨ�ȣ�K2��K1������ | B��K2��K1 |
| C��c2(CO)=c2(NO2) | D��c1(CO)��c2(CO) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 A2��g����B2��g���ﵽƽ��״̬�ı�־��
A2��g����B2��g���ﵽƽ��״̬�ı�־���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com