
 火力发电厂释放出的大量氧化物(NOx)、SO2、CO2会对环境造成污染.对这些废气进行脱硝、脱碳和脱硫处理,可达到节能减排、废物利用等目的.
火力发电厂释放出的大量氧化物(NOx)、SO2、CO2会对环境造成污染.对这些废气进行脱硝、脱碳和脱硫处理,可达到节能减排、废物利用等目的.| 10-14 |
| 10-4 |
| 4 |
| 12 |
| 1 |
| 3 |
| 10-14 |
| 10-4 |
| 10-4 |
| 10-10 |


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
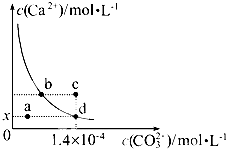 室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10-9,下列说法不正确的是( )
室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10-9,下列说法不正确的是( )| A、加入蒸馏水可使溶液由d点变到a点 |
| B、c点时有碳酸钙沉淀生成 |
| C、x数值为2×10-5 |
| D、b点与d点对应的溶度积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X是地壳中含量最多的元素 |
| Y | Y元素原子核外3p能级上有4个电子 |
| Z | 核素Z的质量数为14、中子数为7 |
| T | T的单质是一种常见的金属,其新制的氢氧化物悬浊液可用于检测糖尿病 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Mn2+ |
| Mn2+ |
| Mn2+ |
| C2O42- |
| 实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪 色时间 (s) | |||
| 0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | 18 | |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度65℃ | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
| 4 | 30 | 20 | x | 20 | 加入5mL 0.10mol/L K2SO4溶液 | 18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液为AgCl的饱和溶液 |
| B、AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C、向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| D、将固体AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,AgCl溶解度小于AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:
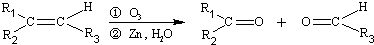 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
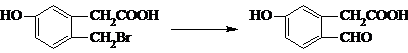
 :
:
 属芳香醚,其同系物的通式为:
属芳香醚,其同系物的通式为:
查看答案和解析>>
科目:高中化学 来源: 题型:
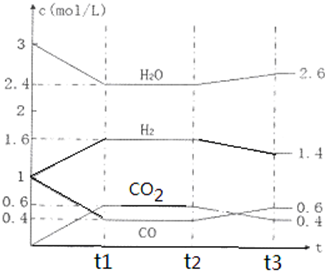

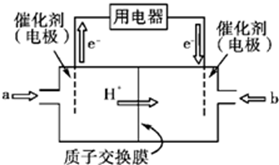
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有AgBr沉淀生成 |
| B、AgCl和AgBr沉淀等量生成 |
| C、AgCl沉淀少于AgBr沉淀 |
| D、AgCl沉淀多于AgBr沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com