
| A、前20 min的平均反应速率v(C)=0.1 mol/(L?min) |
| B、A的转化率为50% |
| C、C的平衡浓度c(C)=4 mol/L |
| D、B的平衡浓度c(B)=1.5 mol/L |
| 2mol/L |
| 20min |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
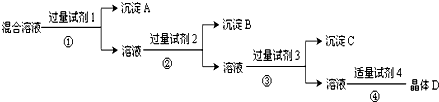
| A、氯化钡溶液 硝酸银溶液 硝酸溶液 |
| B、氯化钡溶液 硝酸溶液 硝酸银溶液 |
| C、NaOH 溶液 硝酸银溶液 硝酸溶液 |
| D、硝酸银溶液 硝酸钡溶液 硝酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.075 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +5,-3 | +3 | +6,-2 | -1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
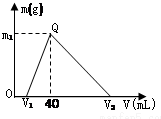 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200mL c(OH-)=0.1mol/L的溶液,然后逐滴加入1mol/L的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200mL c(OH-)=0.1mol/L的溶液,然后逐滴加入1mol/L的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是( )| A、原合金质量为 0.92 g |
| B、图中V2为 100 |
| C、整个加入盐酸过程中 Na+的浓度保持不变 |
| D、Q点m1为0.78 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 电离平衡常数K |
| CH3COOH | 1.76×10- |
| H2CO3 | K1=4.31×10-7 K2=5.61×10-1 |
| H3PO4 | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
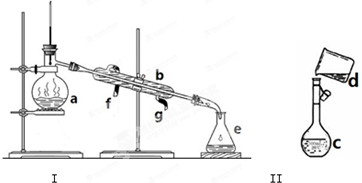 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com