
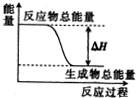
| A. | 灼热的碳与二氧化碳反应 | |
| B. | 碳酸钙的分解 | |
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体混合 | |
| D. | 葡萄糖在人体中转化成二氧化碳和水 |
科目:高中化学 来源: 题型:选择题
| A. | 亚硝酸盐是还原剂 | B. | 维生素C是氧化剂 | ||
| C. | 维生素C被氧化 | D. | 亚硝酸盐发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
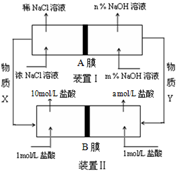 将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )
将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )| A. | 装置I为电解池,装置II为原电池 | |
| B. | 物质X为氯气,物质Y为氢气 | |
| C. | A膜为阳离子交换膜,B膜为阴离子交换膜 | |
| D. | 装置Ⅰ中,m小于n,装置II中a等于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
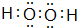 ,其所含化学键为(选代码)bc.
,其所含化学键为(选代码)bc.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5υ(O2)=4υ(NH3) | B. | 6υ(H2O)=5υ(O2) | C. | 3υ(H2O)=2υ(NH3) | D. | 5υ(NO)=4υ(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的某二元弱碱的酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| B. | 25℃时,pH=12的氨水和pH=12的盐酸等体积混合:c(Cl-)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) | |
| C. | 等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合:c(OH-)=c(H+)+c(CH3COOH) | |
| D. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO${\;}_{4}^{2-}$)+c(NH${\;}_{4}^{+}$)+c(H+)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:HX>HZ | B. | 原子半径:Y>X>Z | ||
| C. | 离子半径:X2->Y+>Z- | D. | 元素的最高化合价:Z>X>Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com