
 2SO3(g) ¦¤H="-196" kJˇ¤mol-1ˇŁµ±·´Ó¦´ďµ˝Ć˝şâʱ,ČÝĆ÷ÄÚѹǿ±äÎŞĆđʼʱµÄ0.7±¶ˇŁÇë»Ř´đĎÂÁĐÎĘĚâ:
2SO3(g) ¦¤H="-196" kJˇ¤mol-1ˇŁµ±·´Ó¦´ďµ˝Ć˝şâʱ,ČÝĆ÷ÄÚѹǿ±äÎŞĆđʼʱµÄ0.7±¶ˇŁÇë»Ř´đĎÂÁĐÎĘĚâ:
 2SO3(g)
2SO3(g)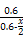 =
= ,˝âµĂx=0.36,ąĘSO2ת»ŻÂĘÎŞ:
,˝âµĂx=0.36,ąĘSO2ת»ŻÂĘÎŞ: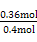 ˇÁ100%=90%ˇŁ·ĹłöČČÁżÎŞ:
ˇÁ100%=90%ˇŁ·ĹłöČČÁżÎŞ: kJˇ¤mol-1ˇÁ0.4 molˇÁ90%="35.28" kJ,K=
kJˇ¤mol-1ˇÁ0.4 molˇÁ90%="35.28" kJ,K=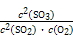 =
= ="20" 250ˇŁ
="20" 250ˇŁ


| Ä꼶 | ¸ßÖĐżÎłĚ | Ä꼶 | łőÖĐżÎłĚ |
| ¸ßŇ» | ¸ßŇ»Ăâ·ŃżÎłĚÍĆĽöŁˇ | łőŇ» | łőŇ»Ăâ·ŃżÎłĚÍĆĽöŁˇ |
| ¸ß¶ţ | ¸ß¶ţĂâ·ŃżÎłĚÍĆĽöŁˇ | łő¶ţ | łő¶ţĂâ·ŃżÎłĚÍĆĽöŁˇ |
| ¸ßČý | ¸ßČýĂâ·ŃżÎłĚÍĆĽöŁˇ | łőČý | łőČýĂâ·ŃżÎłĚÍĆĽöŁˇ |
żĆÄżŁş¸ßÖĐ»ŻŃ§ Ŕ´Ô´Łş˛»Ďę ĚâĐÍŁşµĄŃˇĚâ
 3C(g)Ł¬Čô·´Ó¦żŞĘĽĘ±łäČë2 mol AşÍ1 mol BŁ¬´ďµ˝Ć˝şâşóAµÄĚĺ»ý·ÖĘýÎŞa%ˇŁĆäËűĚőĽţ˛»±äʱŁ¬Čô°´ĎÂÁĐËÄÖÖĹä±Č×÷ÎŞĆđĘĽÎďÖĘŁ¬Ć˝şâşóAµÄĚĺ»ý·ÖĘý´óÓÚa%µÄĘÇ (ˇˇˇˇ)
3C(g)Ł¬Čô·´Ó¦żŞĘĽĘ±łäČë2 mol AşÍ1 mol BŁ¬´ďµ˝Ć˝şâşóAµÄĚĺ»ý·ÖĘýÎŞa%ˇŁĆäËűĚőĽţ˛»±äʱŁ¬Čô°´ĎÂÁĐËÄÖÖĹä±Č×÷ÎŞĆđĘĽÎďÖĘŁ¬Ć˝şâşóAµÄĚĺ»ý·ÖĘý´óÓÚa%µÄĘÇ (ˇˇˇˇ)˛éż´´đ°¸şÍ˝âÎö>>
żĆÄżŁş¸ßÖĐ»ŻŃ§ Ŕ´Ô´Łş˛»Ďę ĚâĐÍŁşµĄŃˇĚâ
| AŁ®SO2Ł«Br2Ł«2H2O=H2SO4Ł«2HBrÓë2HBrŁ«H2SO4Ł¨Ĺ¨Ł©=Br2Ł«SO2ˇüŁ«2H2O»ĄÎŞżÉÄć·´Ó¦ |
| BŁ®ĽČÄÜĎňŐý·´Ó¦·˝Ďň˝řĐĐŁ¬ÓÖÄÜĎňÄć·´Ó¦·˝Ďň˝řĐеķ´Ó¦˝ĐżÉÄć·´Ó¦ |
| CŁ®ÔÚͬһĚőĽţĎÂŁ¬Í¬Ę±ĎňŐýˇ˘ÄćÁ˝¸ö·˝Ďň˝řĐеķ´Ó¦˝ĐżÉÄć·´Ó¦ |
| DŁ®µç˝âË®ÉúłÉÇâĆřşÍŃőĆřÓëÇâĆřşÍŃőĆřµăČĽÉúłÉË®µÄ·´Ó¦ĘÇżÉÄć·´Ó¦ |
˛éż´´đ°¸şÍ˝âÎö>>
żĆÄżŁş¸ßÖĐ»ŻŃ§ Ŕ´Ô´Łş˛»Ďę ĚâĐÍŁşĚîżŐĚâ
 CO (g)+H2 (g)ˇˇ¦¤H="+131" kJˇ¤mol-1
CO (g)+H2 (g)ˇˇ¦¤H="+131" kJˇ¤mol-1| ČÝĆ÷ ±ŕşĹ | c(H2O) /molˇ¤L-1 | c(CO) /molˇ¤L-1 | c(H2) /molˇ¤L-1 | vŐýˇ˘vÄć±Č˝Ď |
| ˘ń | 0.06 | 0.60 | 0.10 | vŐý=vÄć |
| ˘ň | 0.06 | 0.50 | 0.40 | ˘Ů |
| ˘ó | 0.12 | 0.40 | 0.80 | vŐý<vÄć |
| ˘ô | 0.12 | 0.30 | ˘Ú | vŐý=vÄć |
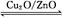 CH3OH(g)ˇˇ¦¤H>0,¸řşĎłÉĽ×´Ľ·´Ó¦ĚĺϵÖĐͨČëÉŮÁżCOÔňĆ˝şâˇˇˇˇˇˇˇˇŇƶŻ,ĽőСѹǿÔňĆ˝şâˇˇˇˇˇˇˇˇŇƶŻ,˝µµÍζČÔňĆ˝şâˇˇˇˇˇˇˇˇˇˇˇˇˇˇˇˇŇƶŻ(ĚĎň×󡱡˘ˇ°ĎňÓҡ±»ňˇ°˛»ˇ±)ˇŁ
CH3OH(g)ˇˇ¦¤H>0,¸řşĎłÉĽ×´Ľ·´Ó¦ĚĺϵÖĐͨČëÉŮÁżCOÔňĆ˝şâˇˇˇˇˇˇˇˇŇƶŻ,ĽőСѹǿÔňĆ˝şâˇˇˇˇˇˇˇˇŇƶŻ,˝µµÍζČÔňĆ˝şâˇˇˇˇˇˇˇˇˇˇˇˇˇˇˇˇŇƶŻ(ĚĎň×󡱡˘ˇ°ĎňÓҡ±»ňˇ°˛»ˇ±)ˇŁ ˛éż´´đ°¸şÍ˝âÎö>>
żĆÄżŁş¸ßÖĐ»ŻŃ§ Ŕ´Ô´Łş˛»Ďę ĚâĐÍŁşµĄŃˇĚâ
AŁ®Ć˝şâşó°±ĆřµÄ·Ö˝âÂĘÎŞ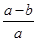 ˇÁ100% ˇÁ100% |
BŁ®Ć˝şâ»ěşĎĆřĚĺÖĐH2µÄĚĺ»ý·ÖĘýÎŞ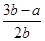 ˇÁ100% ˇÁ100% |
CŁ®·´Ó¦Ç°şóĆřĚĺµÄĂܶȱČÎŞ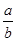 |
DŁ®Ć˝şâşóĆřĚĺµÄĆ˝ľůĦ¶űÖĘÁżÎŞ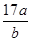 g g |
˛éż´´đ°¸şÍ˝âÎö>>
żĆÄżŁş¸ßÖĐ»ŻŃ§ Ŕ´Ô´Łş˛»Ďę ĚâĐÍŁşĚîżŐĚâ
 C(g)Ł«D(g) ¦¤HŁĽ0ˇŁÇë»Ř´đĎÂÁĐÎĘĚâ:
C(g)Ł«D(g) ¦¤HŁĽ0ˇŁÇë»Ř´đĎÂÁĐÎĘĚâ:˛éż´´đ°¸şÍ˝âÎö>>
żĆÄżŁş¸ßÖĐ»ŻŃ§ Ŕ´Ô´Łş˛»Ďę ĚâĐÍŁşµĄŃˇĚâ
 3R(g) ¦¤H>0Ł¬ČçÍĽ±íĘľÍâ˝çĚőĽţζȡ˘ŃąÇżµÄ±ä»Ż¶ÔÉĎĘö·´Ó¦µÄÓ°Ď졣ĎÂÁбíĘöŐýČ·µÄĘÇ( )
3R(g) ¦¤H>0Ł¬ČçÍĽ±íĘľÍâ˝çĚőĽţζȡ˘ŃąÇżµÄ±ä»Ż¶ÔÉĎĘö·´Ó¦µÄÓ°Ď졣ĎÂÁбíĘöŐýČ·µÄĘÇ( )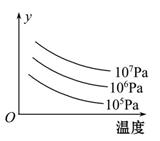
| AŁ®¸Ă·´Ó¦´ďĆ˝şâşóĽÓČëĘʵ±µÄ´ß»ŻĽÁżÉĚá¸ßGµÄת»ŻÂĘ |
| BŁ®´ďµ˝Ć˝şâşóĎňČÝĆ÷ÖĐĽÓČëLŁ¬Ć˝şâĎňÓŇŇƶŻŁ¬GµÄת»ŻÂĘÔö´ó |
| CŁ®ÍĽÖеÄyżÉÄÜĘÇĆ˝şâ»ěşĎĆřÖĐGµÄÖĘÁż·ÖĘý |
| DŁ®ÍĽÖеÄyżÉÄÜĘǴﵽƽşâʱGµÄת»ŻÂĘ |
˛éż´´đ°¸şÍ˝âÎö>>
żĆÄżŁş¸ßÖĐ»ŻŃ§ Ŕ´Ô´Łş˛»Ďę ĚâĐÍŁşµĄŃˇĚâ
 2NH3Ł¨gŁ©ˇˇ¦¤HŁ˝Ł92.6 kJ/molˇŁĘµŃé˛âµĂĆđĘĽˇ˘Ć˝şâʱµÄÓĐąŘĘýľÝČç±íËůĘľŁ¬ĎÂÁĐĐđĘö´íÎóµÄĘÇŁ¨ˇˇˇˇŁ©
2NH3Ł¨gŁ©ˇˇ¦¤HŁ˝Ł92.6 kJ/molˇŁĘµŃé˛âµĂĆđĘĽˇ˘Ć˝şâʱµÄÓĐąŘĘýľÝČç±íËůĘľŁ¬ĎÂÁĐĐđĘö´íÎóµÄĘÇŁ¨ˇˇˇˇŁ©| | Ćđʼʱ¸÷ÎďÖʵÄÎďÖĘ µÄÁżŁ¨molŁ© | ´ďµ˝Ć˝şâʱÄÜÁż±ä»Ż | ||
| ČÝĆ÷±ŕşĹ | N2 | H2 | NH3 | |
| ˘Ů | 1 | 3 | 0 | ·Ĺłö23.15 kJÄÜÁż |
| ˘Ú | 0.9 | 2.7 | 0.2 | ·ĹłöQ kJÄÜÁż |
˛éż´´đ°¸şÍ˝âÎö>>
żĆÄżŁş¸ßÖĐ»ŻŃ§ Ŕ´Ô´Łş˛»Ďę ĚâĐÍŁşµĄŃˇĚâ
 N2O4(g)ˇˇ¦¤H<0ĎÖ˝«Ň»¶¨ÁżNO2şÍN2O4µÄ»ěşĎĆřĚĺͨČëĚĺ»ýÎŞ1 LµÄşăÎÂĂܱŐČÝĆ÷ÖĐ,·´Ó¦ÎďŨ¶ČËćʱĽä±ä»ŻąŘϵČçÍĽˇŁĎÂÁĐ˵·¨ÖĐŐýČ·µÄĘÇ(ˇˇˇˇ)
N2O4(g)ˇˇ¦¤H<0ĎÖ˝«Ň»¶¨ÁżNO2şÍN2O4µÄ»ěşĎĆřĚĺͨČëĚĺ»ýÎŞ1 LµÄşăÎÂĂܱŐČÝĆ÷ÖĐ,·´Ó¦ÎďŨ¶ČËćʱĽä±ä»ŻąŘϵČçÍĽˇŁĎÂÁĐ˵·¨ÖĐŐýČ·µÄĘÇ(ˇˇˇˇ)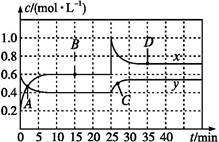
˛éż´´đ°¸şÍ˝âÎö>>
°Ů¶ČÖÂĐĹ - Á·Ď°˛áÁбí - ĘÔĚâÁбí
şţ±±Ęˇ»ĄÁŞÍřÎĄ·¨şÍ˛»ÁĽĐĹϢľŮ±¨Ć˝Ě¨ | ÍřÉĎÓĐş¦ĐĹϢľŮ±¨×¨Çř | µçĐĹթƾٱ¨×¨Çř | ÉćŔúĘ·ĐéÎŢÖ÷ŇĺÓĐş¦ĐĹϢľŮ±¨×¨Çř | ÉćĆóÇÖȨľŮ±¨×¨Çř
ÎĄ·¨şÍ˛»ÁĽĐĹϢľŮ±¨µç»°Łş027-86699610 ľŮ±¨ÓĘĎ䣺58377363@163.com