
【题目】现有三组溶液:①菜籽油和氯化钠溶液、②75%的医用酒精、③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.过滤 萃取 分液B.萃取 分液 蒸馏
C.分液 蒸馏 萃取D.萃取 蒸馏 分液
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤正确的是
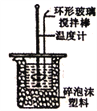
A. 为了减小热量损失,倒入NaOH溶液应该多次迅速倒人
B. 用套在温度计上的环形玻璃搅拌棒上下轻轻地搅动
C. 烧杯如不盖硬纸板,不影响测得的中和热数值
D. 先用一支温度计测量盐酸温度,再用另一支温度计测量氢氧化钠溶液温度,并做好记录
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:O2(g)+S(s)=SO2(g)△H=一akJ/mol
O2(g)+2SO2(g)![]() 2S03(g)△H=-bkJ/mol
2S03(g)△H=-bkJ/mol
写出SO3(g)分解生成O2(g)与S(s)的热化学方程式:_______________________。
(2)研究SO2催化氧化生成SO3的反应,回答下列相关问题:
①甲图是SO2(g)和SO3(g)的浓度随时间的变化情况。反应从开始到平衡时,用SO2表示的平均反应速率为_________。

②在一容积可变的密闭容器中充入20molSO2(g)和10molO2(g),02的平衡转化率随温度(T)、压强(P)的变化如图乙所示。则P1与P2的大小关系是P2_____P1(“>”“<”或“=”),A、B、C三点的平衡常数大小关系为______(用K、Kg、K。和“<”“>”或“=”表示)。
(3)常温下,H2SO3的电离平衡常数Ka1=1.5510-2Ka2=1.02×10-7。
①将SO2通入水中反应生成H2SO3。试计算常温下H2SO3![]() 2H++S032-的平衡常数K=____。(结果保留小数点后两位数字)
2H++S032-的平衡常数K=____。(结果保留小数点后两位数字)
②浓度均为0.1mol/L的Na2SO3、NaHSO3混合溶液中,![]() =______________。
=______________。
(4)往1L0.2mol/LNa2SO3溶液中加入等体积的0.1mol/L的CaCl2溶液,充分反应后(忽略溶液体积变化),溶液中c(Ca2+)=______。(已知,常温下Ksp(CaSO3)=1.28×10-9)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.硅元素是地壳中含量最多的元素
B.自然界中二氧化硅主要存在于石英矿和硅酸盐中
C.石英、水晶、玛瑙的主要成分都是二氧化硅
D.玛瑙是具有彩色环带状或层状的石英晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知15.5 g CO、HCOOCH3、HCHO、CH3COOH的混合物在O2中完全燃烧都生成水和CO2,将其产物通过足量的Na2O2后,则Na2O2固体增重为( )
A.14.7 gB.16.1 gC.15.5 gD.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关科学家及其创建理论的描述中,错误的是( )
A. 汤姆生提出葡萄干面包式模型 B. 道尔顿创立分子学说
C. 门捷列夫发现了元素周期律 D. 卢瑟福提出了核式原子模型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱金属按原子序数递增的顺序,其单质的性质变化不正确的是( )
A.单质的还原性依次增强
B.与水反应生成的氢氧化物碱性增强
C.与氧气反应的剧烈程度增强
D.熔点、沸点依次升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液 A中可能含有如下离子:Na+、NH4+、Ba2+、Mg2+、SO42-、SO32-、Cl-、OH-。某同学设计并完成了如下的实验:
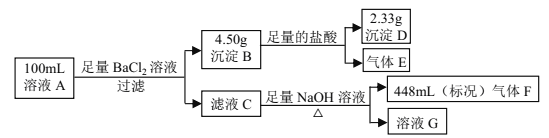
下列说法正确的是
A. 溶液 A 中一定存在 NH4+、 SO42-、 SO32-,可能存在 Na+
B. 溶液 A 中一定存在 NH4+、 Mg2+、 SO42-、 SO32-,可能存在 Cl-
C. 溶液 A 中可能存在 Cl-,且 c(Na+) ≥ 0.20 mol·L-1
D. 如果气体 F 能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有 NH4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com