
| A. | 石灰石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | CuCl2溶液中投入单质Na:2Na+Cu2+═2Na++Cu | |
| C. | FeCl3溶液中投入单质Cu:Fe3++Cu═Fe2++Cu2+ | |
| D. | 碳酸氢钠溶液与少量澄清石灰水反应:HCO3-+Ca2++2OH-═CaCO3↓+H2O+CO32- |
分析 A.醋酸在离子反应中保留化学式;
B.Na先与水反应,生成氢氧化铜、氢气、氯化钠;
C.反应生成氯化亚铁、氯化铜,电子、电荷不守恒;
D.反应生成碳酸钙、碳酸钠和水.
解答 解:A.石灰石溶于醋酸的离子反应为CaCO3+2CH3COOH═2CH3COO-+Ca2++H2O+CO2↑,故A错误;
B.CuCl2溶液中投入单质Na的离子反应为2H2O+2Na+Cu2+═2Na++Cu(OH)2↓+H2↑,故B错误;
C.FeCl3溶液中投入单质Cu的离子反应为2Fe3++Cu═2Fe2++Cu2+,故C错误;
D.碳酸氢钠溶液与少量澄清石灰水反应的离子反应为HCO3-+Ca2++2OH-═CaCO3↓+H2O+CO32-,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2、NO2、CO2这些酸性氧化物的大量排放是造成酸雨的主要原因 | |
| B. | 用米汤可检验食用盐是否为加碘盐 | |
| C. | iPhone6s外壳上贴的碳纤维外膜是一种新型无机非金属材料 | |
| D. | “地沟油”不能食用,但对其进行分馏可获得柴油 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
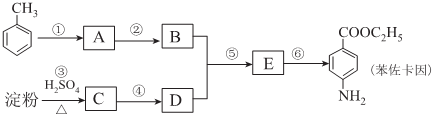
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (有弱碱性,易被氧化).
(有弱碱性,易被氧化).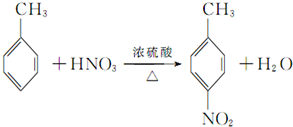 ,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为2,4,6-三硝基甲苯.
,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为2,4,6-三硝基甲苯.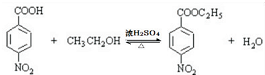 .
. .
. 是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图:
是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、S2- | |
| B. | 使酚酞变红的溶液中可能大量存在Na+、ClO?、SO42-、I? | |
| C. | 碱性溶液中可能大量存在Na+、K+、HCO3?、CO32- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 常温常压下,L是一种液态有机物 | B. | E中化学键是极性键 | ||
| C. | F具有漂白性 | D. | 上述反应的类型是取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:选择题
已知Q与R的摩尔质量之比为9:22。在反应X+2Y
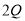 +R中,当1.6g X与Y完全反应后,生成4.4g R,则参与反应的Y和生成物
+R中,当1.6g X与Y完全反应后,生成4.4g R,则参与反应的Y和生成物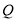 的质量比为
的质量比为
A.46:9 B.32:9 C.23:9 D.16:9
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上10月月考化学试卷(解析版) 题型:实验题
某化学研究性学习小组以海带为原料制取了少量碘水.现用四氯化碳从碘水中萃取碘并用分液漏斗分离两种溶液.其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
C.检查分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转分液漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞,分液漏斗放正;
E.旋开活塞,用烧杯承接溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
H.静置、分层;
就此实验,完成下列填空:
(1)正确操作步骤的顺序是(用上述各操作的编号字母填写)______________________
(2)上述E步骤的操作中应注意 ;上述G步骤操作的目的是_________
(3)能选用四氯化碳从碘水中萃取碘的原因是_______________________
(4)已知碘在酒精中的溶解度比在水中大得多,能不能用酒精来萃取碘水中的碘(填“能”或“不能”)_____________,其理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com