
【题目】ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题。
(1)基态Ga原子价层电子排布式_____。
(2)砷化镓属于第三代半导体,晶胞结构与金刚石相似。下列说法正确的是_____。
A.砷化镓晶胞结构中Ga原子的轨道杂化方式为sp3
B.第一电离能:As<Ga
C.电负性:As<Ga
D.砷和镓都属于p区元素
(3)BCl3的立体构型是____,由第二周期元素组成的与BCl3互为等电子体的阴离子为____。
(4)已知:Al的燃烧热为△H1=akJ·mol-1;Fe2O3(s)+2Al(s)=Al2O3(s)+2Fe(s);ΔH2=bkJ/mol,则:3O2(g)+4Fe(s)=2Fe2O3(s);ΔH3=____kJ/mol。
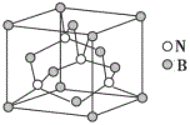
(5)人造立方氮化硼晶胞如图所示,判断该晶体结构中存在配位键的依据是____。设该晶体的摩尔质量为Mg/mol,晶体的密度为ag/cm3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的B原子之间的距离为____cm。
【答案】4s24p1 AD 平面三角形 NO3-或CO32- 4a-2b BN晶体中,每1个B原子与4个N原子结合,而B原子只有3个价电子,故需提供1个空轨道形成配位键 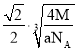
【解析】
(1)Ga为31号元素,可利用电子进入轨道的顺序写出电子排布式,再写出原子价层电子排布式。
(2) 砷与镓都位于元素周期表的第四周期,且砷在镓的右边,所以非金属性As>Ga。
A.砷化镓晶胞结构与金刚石相似,则Ga原子的轨道杂化方式与C相同;
B.第一电离能与非金属性基本相同,出现反常的也只是相邻的价电子层处于半满或全满状态的元素;
C.As、Ga的电负性与非金属性关系相同;
D.砷和镓中,能量高的电子排布在p轨道;
(3)由B原子的价层电子对数,推断BCl3的立体构型,由第二周期元素组成的与BCl3互为等电子体的阴离子,可从与B、Cl相邻的元素进行分析。
(4)利用盖斯定律可计算反应3O2(g)+4Fe(s)=2Fe2O3(s)的ΔH3。
(5)判断晶体结构中存在配位键时,可从B的价层电子对数进行分析。计算晶体中两个距离最近的B原子之间的距离(为面上对角线的一半)时,可先算出晶体的参数,再求距离最近的两个B之间的距离。
(1) Ga为31号元素,基态Ga原子的电子排布式为1s22s22p63s23p63d104s24p1,所以价层电子排布式为4s24p1。答案为:4s24p1;
(2)砷与镓都位于元素周期表的第四周期,且砷在镓的右边,所以非金属性As>Ga。
A.砷化镓晶胞结构中,Ga原子与周围的4个Ga原子形成共价键,价层电子对数为4,则轨道杂化方式为sp3,A正确;
B.因为非金属性As>Ga,As价电子轨道处于半充满状态,所以第一电离能:As>Ga,B错误;
C.非金属性越强,电负性越大,则电负性As>Ga,C错误;
D.砷和镓原子中,价层电子都排布在s、p轨道,所以它们都属于p区元素,D正确;
故AD正确;答案为:AD;
(3)BCl3分子中,B原子的价层电子对数为3,所以立体构型是平面三角形;寻找与BCl3互为等电子体的阴离子,可用O替代Cl,则另一原子可能为C或N,从而得出阴离子为NO3-或CO32-。答案为:平面三角形;NO3-或CO32-;
(4)已知:Al(s)+![]() O2(g)=
O2(g)=![]() Al2O3(s) △H1=akJ·mol-1 ①
Al2O3(s) △H1=akJ·mol-1 ①
Fe2O3(s)+2Al(s)=Al2O3(s)+2Fe(s);ΔH2=bkJ/mol ②
利用盖斯定律,将①×4-②×2得:3O2(g)+4Fe(s)=2Fe2O3(s);ΔH3=4a-2b kJ/mol。答案为:4a-2b;
(5)B原子的价层电子对数为3,但B原子形成了4个共价键,则该晶体结构中存在配位键,判断依据是:BN晶体中,每1个B原子与4个N原子结合,而B原子只有3个价电子,故需提供1个空轨道形成配位键。在1个BN晶胞中,含有4个“BN”,设晶胞的棱长为x,则x3=![]() ,从而求出x=
,从而求出x=![]() ,晶体中两个距离最近的B原子之间的距离为
,晶体中两个距离最近的B原子之间的距离为![]() =
=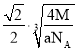 cm。答案为:BN晶体中,每1个B原子与4个N原子结合,而B原子只有3个价电子,故需提供1个空轨道形成配位键;
cm。答案为:BN晶体中,每1个B原子与4个N原子结合,而B原子只有3个价电子,故需提供1个空轨道形成配位键;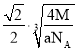 。
。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】其它燃料电池负极(燃料)电极反应式的书写
(1)烃燃料电池
①酸性介质
CH4:1CH4—8 e—+2H2O= 1CO2+8H+
C2H6 :____________
C2H2 : ___________
②碱性介质
CH4:1CH4—8 e—+ 10OH—= 1 CO32—+ 7 H2O
C2H6:1 C2H6—14e— + 18OH—= 2CO32—+12H2O
C2H2:______________
(2)烃的含氧衍生物燃料电池
①酸性介质
CH3OH:1CH3OH—6e—+1H2O = 1CO2+6 H+
C2H5OH: ______________
CH3OCH3:_____________
②碱性介质
CH3OH: 1CH3OH—6e—+8OH —= 1CO32—+ 6 H2O
C2H5OH: ___________
CH3OCH3:___________
(3)熔融碳酸盐为电解质
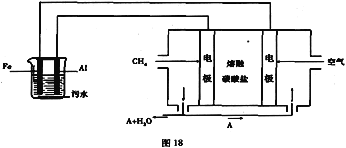
负极(CH4):___________
正极(O2):______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z三种元素均为短周期元素,原子序数依次递增,Q、W为前30号元素。5种元素的部分特点:
元素 | 特点 |
X | 其气态氢化物呈三角锥形,水溶液显碱性 |
Y | 基态原子核外有三个能级,其中最外层电子数等于次外层电子数的3倍 |
Z | 元素原子的外围电子层排布式为nsn-1npn-1 |
Q | 被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
W | 原子M能级层为全充满状态且核外的未成对电子只有一个 |
(1)XF3分子中X的杂化类型为______,该分子的空间构型为_______.
(2)基态Q原子的电子排布式为_____________________,第一电离能:X______Y(填“>” “<”或“=”) .
(3)X、Y、Z电负性由大到小的顺序为____________(用元素符号表示).
(4)Na在Y2中燃烧产物的电子式为________________.
(5)Z和X形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于_______晶体.
(6)W元素与X元素形成某种化合物的晶胞结构如图所示(黑球代表W原子),若该晶体的密度为ρ g·cm-3,则该晶胞的体积是__________cm3.
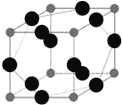
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A. 工业制硫酸在二氧化硫催化氧化时采用高温来提高单位时间SO3的产量
B. 合成氨工业中使用铁触媒做催化剂来加快反应速率
C. 用饱和食盐水来除去氯气中氯化氢杂质
D. 对于2HI(g)![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 为阿伏加德罗常数的值。下列说法正确的是( )
A.18gD2O 和 18gH2O 中含有的质子数均为 10NA
B.12 g 石墨烯(单层石墨)中含有六元环的个数为 0.5 NA
C.标准状况下,5.6LCO2 与足量 Na2O2 反应转移的电子数为0.5 NA
D.某密闭容器盛有 1 mol N2 和 3 mol H2,在一定条件下充分反应,转移电子的数目为 6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元弱碱B(OH)2(K1=5.9×10-2、K2=6.4×10-5)。向10mL稀B(OH)2溶液中滴加等浓度盐酸溶液,B(OH)2、B(OH)+、B2+的浓度分数δ随溶液POH[POH=-lgc(OH)-]变化的关系如图,以下说法正确的是
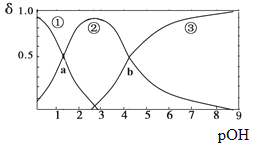
A. 交点a处对应加入的盐酸溶液的体积为5mL
B. 当加入的盐酸溶液的体积为10mL时存在c(Cl-)>c(B(OH)+)>c(H+)>c(OH-)>c(B2+)
C. 交点b处c(OH)=6.4×10-5
D. 当加入的盐酸溶液的体积为15mL时存在:c(Cl-)+c(OH-)= c(B2+)+c(B(OH)+)+ c(H+),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单一盐溶液中离子浓度比较
(1)NH4Cl溶液中存在的水解平衡是________,使c(H+)___c(OH-)、c(Cl-)_____c(NH4+),盐类的水解是很微弱的,所以溶液中剩余未水解的NH4+的浓度_______水解产生的OH-的浓度。所以溶液中离子浓度大小关系是________。
(2)Na2CO3溶液中存在的水解平衡是__________、_______离子浓度大小关系是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A(分子式C8H8O3)为无色液体,难溶于水,有特殊香味。从A出发,可发生如下图所示的一系列反应,图中的化合物A硝化时可生成四种一硝基取代物,化合物H的分子式为C6H6O,G能发生银镜反应。

回答下列问题:
(1)写出下列化合物可能的结构简式:
A________,E_______,K ________。
(2)反应类型(Ⅰ)________,(Ⅱ)________,(Ⅲ)_______。
(3)反应方程式:H―→K_________,C+F―→_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com