
已知H2(g)+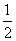 O2(g)===H2O(g),反应过程中能量变化如图,问:
O2(g)===H2O(g),反应过程中能量变化如图,问:
(1)a、b、c分别代表什么意义?
a______________;b____________;c__________。
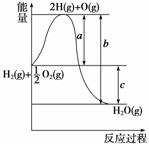
(2)该反应是放热反应还是吸热反应?__________。ΔH大于零还是小于零?________
(3)若已知2H2(g)+O2(g)===2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)===2H2O(l) ΔH2=-Q2
则ΔH1______ΔH2,Q1______Q2(填“>”、“<”或“=”)。
答案 (1)代表旧键断裂吸收的能量 代表新键形成释放出的能量 代表反应热 (2)放热反应 小于零 (3)> <
解析 解答本题时要明确以下三点:
(1)反应热等于旧化学键断裂吸收的能量与新化学键生成放出的能量差。
(2)物质由气态转化成液态要放出热量。
(3)比较ΔH的大小,要连同“+”、“-”号包括在内。
(1)H2(g)和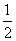 O2(g)与2H(g)和O(g)之间的能量差是H2—→2H(g)和
O2(g)与2H(g)和O(g)之间的能量差是H2—→2H(g)和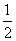 O2(g)—→O(g)过程中断开H—H键和O===O键需吸收的能量。所以a代表旧键断裂吸收的能量,b代表2H(g)+O(g)结合成氢氧键所放出的能量,c则代表断键所吸收的能量-成键所释放的能量,即a-b=c。
O2(g)—→O(g)过程中断开H—H键和O===O键需吸收的能量。所以a代表旧键断裂吸收的能量,b代表2H(g)+O(g)结合成氢氧键所放出的能量,c则代表断键所吸收的能量-成键所释放的能量,即a-b=c。
(2)由图可知该反应中反应物总能量大于生成物总能量,所以该反应为放热反应,ΔH<0。
(3)比较ΔH大小时,要连同“+”、“-”包含在内,类似于数学上的正负数比较,如果只比较反应放出热量多少,则只比较数值大小,与“+”、“-”无关。


科目:高中化学 来源: 题型:
解析下列事实的离子方程式不正确的是
A. 氨水使湿润的红色石蕊试纸变蓝:
B. 工业上用过量的溶液吸收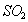 :
: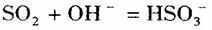
C. 用烧碱溶液清洗铝表面的氧化膜: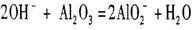
D. 用石灰乳吸收泄漏的氯气: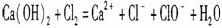
查看答案和解析>>
科目:高中化学 来源: 题型:
若把长式元素周期表原先的副族、主族及族号取消,由左至右改为18列,如碱金属元素为第1列,稀有气体元素为第18列。按此规定,下列说法中错误的是 ( )
A.第9列元素中没有非金属元素
B.只有第2列元素原子最外层有2个电子
C.第16列元素均为非金属元素
D.在整个18列元素中,第3列的元素种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.反应焓变是指1 mol物质参加反应时的能量变化
B.当反应放热时,ΔH>0,反应吸热时,ΔH<0
C.在加热条件下发生的反应均为吸热反应
D.一个化学反应中,当反应物能量大于反应产物能量时,反应放热,ΔH为“-”
查看答案和解析>>
科目:高中化学 来源: 题型:
在100 kPa和298 K时,有关反应的热化学方程式有:
H2(g)+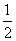 O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
H2(g)+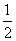 O2(g)===H2O(l) ΔH2=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH2=-285.8 kJ·mol-1
下列说法错误的是( )
A.H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量
B.O2前面的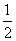 表示参加反应的O2的分子数目
表示参加反应的O2的分子数目
C.1mol物质完全燃烧生成稳定氧化物时放出的热量为燃烧热,H2的燃烧热为285.8 kJ·mol-1
D.1 mol液态水变成水蒸气时吸收44 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是( )
A.2SO2(g)+O2(g)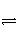
 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
B.2SO2(g)+O2(g)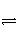
 2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
C.SO2(g)+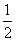 O2(g)
O2(g)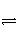
 SO3(g) ΔH=98.3 kJ·mol-1
SO3(g) ΔH=98.3 kJ·mol-1
D.SO2(g)+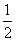 O2(g)
O2(g)
 SO3(g) ΔH=-196.6 kJ·mol-1
SO3(g) ΔH=-196.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
依据叙述,写出下列反应的热化学方程式。
(1)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量。其热化学方程式为________________________________________________________________________
________________________________________________________________________。
(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。其热化学方程式为
________________________________________________________________________
________________________________________________________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、
391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
周期表中17号元素的原子37Cl和6号元素的原子13C的原子相比较,前者的下列数据是后者的4倍的是( )
A.中子数 B.最外层电子数
C.电子层数 D.次外层电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
某原电池总反应为:Cu+2Fe3+====Cu2++2Fe2+下列能实现该反应的原电池
是 ( )
| A | B | C | D | |
| 电极材料 | Cu、Zn | Cu、C | Fe、Zn | Cu、Ag |
| 电解液 | FeCl3 | Fe(NO3)2 | CuSO4 | Fe2(SO4)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com