NaClO具有强氧化性,其溶液可用于游泳池及环境消毒.
(1)已知:
①Cl
2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H
2O(l)△H=-101.1kJ?mol
-1②3NaClO(aq)=2NaCl(aq)+NaClO
3(aq)△H=-112.2kJ?mol
-1则3Cl
2(g)+6NaOH(aq)=5NaCl(aq)+NaClO
3(aq)+3H
2O(l)△H=
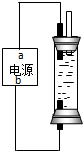
(2)工业上可用石墨电极电解饱和氯化钠溶液制取次氯酸钠溶液装置如图所示
①电源中,a电极名称是
②用此装置电解热的氯化钠溶液时会有部分氯酸钠生成,若电解消耗了117g氯化钠时,电路中共转移的电子为8mol,则次氯酸钠的产率为
(3)向次氯酸钠溶液通入少量的CO
2,只生成次氯酸钠和碳酸氢钠,则相同温度下,等物质的量浓度的Na
2CO
3、NaClO、NaHCO
3溶液的pH由大到小的顺序为
.
(4)向盛有硫酸酸化的淀粉KI溶液的试管中,滴加少量次氯酸钠溶液,会立即观察到溶液变成蓝色,该反应的离子方程式为
再向上述的蓝色溶液中,继续滴加Na
2SO
3溶液,又发现蓝色溶液逐渐褪色,该反应的化学方程式为
.对比上述两组实验所得结果,比较ClO
-、I
2、SO
42- 三种微粒氧化性由强到弱的顺序
.



 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
 甲醇可作电池的原料,也会造成环境污染.请根据有关反应回答问题.
甲醇可作电池的原料,也会造成环境污染.请根据有关反应回答问题. NaClO具有强氧化性,其溶液可用于游泳池及环境消毒.
NaClO具有强氧化性,其溶液可用于游泳池及环境消毒.