
| A、铜铸塑像上出现铜绿[Cu2(0H)2C03] |
| B、用石膏点豆腐 |
| C、不良商贩用硫黄熏蒸法制作“白豆芽” |
| D、自来水厂用氯气对水进行消毒 |


科目:高中化学 来源: 题型:
| A、+2 | B、+3 | C、+4 | D、+5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
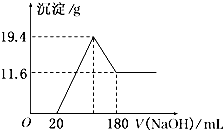 将可能含有少量碳、硅杂质的a克镁铝合金投入100mL一定物质的量浓度的盐酸中,合金部分溶解,过滤,向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示.
将可能含有少量碳、硅杂质的a克镁铝合金投入100mL一定物质的量浓度的盐酸中,合金部分溶解,过滤,向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3溶液中加入醋酸溶液:HCO3-+H+=CO2↑+H2O | ||
| B、NaAlO2溶液中通入过量CO2气体:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | ||
| C、Fe(OH)2溶于足量稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | ||
D、乙醛与含有NaOH的Cu(OH)2悬浊液共热:CH3CHO+OH-+2Cu(OH)2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ② |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mn2O3 |
| B、Mn2+ |
| C、MnO2 |
| D、K2MnO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、SO42-、Cl- |
| B、Fe2+、H+、SO42-、NO3- |
| C、H+、K+、HCO3-、Cl- |
| D、Mg2+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
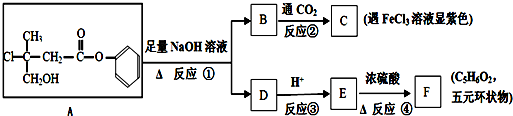
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com