
| A、由水电离的c(H+)=1×10-14mol?L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
| B、甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- |
| C、在pH=0的溶液中,Na+、NO3-、SO32-、K+ |
| D、pH=12的溶液:K+、Na+、CH3COO-、Br- |


科目:高中化学 来源: 题型:
| 丁 |
| 丁 |
| 甲 |
| A、若甲为Cl2,则丁可能是铁 |
| B、若甲为NH3,则丁可能是氧气 |
| C、若甲为AlCl3溶液,则丁可能是氨水 |
| D、若甲为NaOH,则丁可能是SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
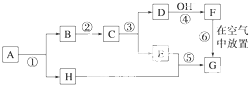
查看答案和解析>>
科目:高中化学 来源: 题型:
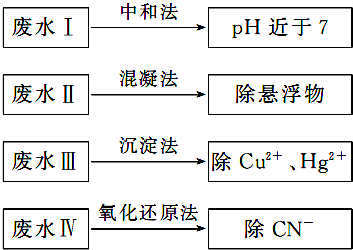
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO4的溶度积常数比BaCO3的小 |
| B、S没有毒性,C有毒性 |
| C、BaSO4的密度大 |
| D、胃酸能与CO32-结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有AgCl沉淀析出 |
| B、无AgCl沉淀 |
| C、无法确定 |
| D、有沉淀但不是AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| 5n(NO)(mol) | 0.020 | 0.010 | 0.006 | 0.004 | 0.004 | 0.004 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正极反应为4OH--4e-═O2↑+2H2O |
| B、放电时,CO32- 向负极移动 |
| C、电池供应1 mol水蒸气,转移的电子的物质的量为4 mol |
| D、放电时CO32-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱性氧化物 过氧化钠 Na2O2 |
| B、碱 纯碱 Na2CO3 |
| C、金属氧化物 氧化铁 FeO |
| D、非金属氧化物 三氧化硫 SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com