
【题目】(1)有以下几种物质①干燥的食盐晶体 ②液态氯化氢 ③Cu ④蔗糖 ⑤NH3 ⑥KNO3溶液 ⑦CO2 ⑧熔融的KCl ⑨石墨。填空回答(填序号):以上物质中能导电的是______________;属于电解质的是__________;属于非电解质的是______________;
(2)用“双线桥”表示出反应中电子转移的方向和数目:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O_______
(3)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐为重要化合物。高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________。
【答案】 ③⑥⑧⑨ ①②⑧ ④⑤⑦  2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
【解析】分析:(1)根据电解质与非电解质的概念判断;含有自由移动电子或离子的物质可以导电;
(2)根据元素的化合价变化结合电子得失守恒判断;
(3)根据元素的化合价变化结合电子得失守恒、原子守恒和电荷守恒书写。
详解:(1)电解质是在水溶液里或熔化状态下能够自身电离出离子的化合物的化合物,属于电解质的是干燥的食盐晶体、液态氯化氢、熔融的KCl;非电解质是在水溶液里和熔融状态下都不能自身电离出离子的化合物,属于非电解质的是蔗糖、NH3、CO2;能导电的是金属铜、硝酸钾溶液、熔融的KCl和石墨;
(2)碘酸钾中碘元素化合价从+5价降低到0价,碘化钾中碘元素化合价从-1价升高都0价,则根据电子得失守恒可知用“双线桥”表示出反应中电子转移的方向和数目为 。
。
(3)铁元素化合价从+3价升高到+6价,氯元素化合价从+1价降低到-1价,所以根据电子得失守恒可知其反应的离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答相关的问题。
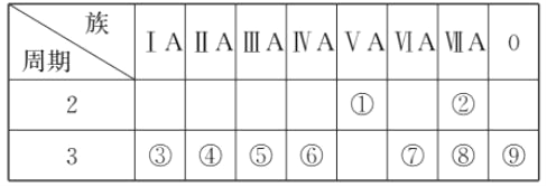
(1)写出④的元素符号________。
(2)在这些元素中,最活泼的金属元素与水反应的离子方程式:___________________________。
(3)在这些元素中,最高价氧化物的水化物酸性最强的是________(填相应化学式,下同),碱性最强的是________。
(4)这些元素中(除⑨外),原子半径最小的是________(填元素符号,下同),原子半径最大的是________。
(5)②的单质与③的最高价氧化物的水化物的溶液反应,其产物之一是OX2 , (O、X分别表示氧和②的元素符号,即OX2代表该化学式),该反应的离子方程式为(方程式中用具体元素符号表示) _____________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是
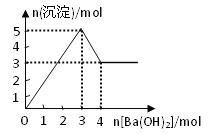
A. MgSO4 B. KAl(SO4)2 C. Al2(SO4)3 D. NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将两烧杯中电极用导线相连,四个电极分别为Mg、Al、Pt、C。当闭合开关S后,以下表述正确的是( )

A. 电流表指针不发生偏转 B. Al、Pt两极有H2产生
C. 甲池pH增大,乙池pH减小 D. Mg、C两极生成的气体在一定条件下可以恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生理盐水是溶质质量分数为0.9%的氯化钠溶液,现用1000g生理盐水给某病人输液,进入病人体内的氯化钠的质量为( )
A.0.9gB.9gC.90gD.18g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com