
25 ℃时,水的电离达到平衡:H2O H++OH- ΔH>0,下列叙述正确的是( )
H++OH- ΔH>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体NaOH,平衡逆向移动,c(H+)降低,KW减小
D.将水加热,KW增大,pH不变
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)4.3.1电解原理试卷(解析版) 题型:填空题
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
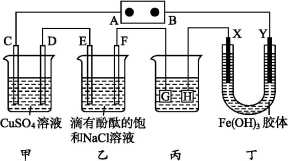
请回答:
(1)B极是电源的 ,一段时间后,甲中溶液颜色 ,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 ,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“铜件”),电镀液是 溶液。当乙中溶液的pH是13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为 ,甲中溶液的pH (填“变大”“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.4难溶电解质的溶解平衡(解析版) 题型:选择题
已知BaCO3、BaSO4溶度积常数分别为Ksp=5.1×10-9 mol2·L-2,Ksp=1.1×10-10 mol2·L-2,则BaSO4可作钡餐,BaCO3不能作钡餐的主要理由是( )
A.BaSO4的溶度积常数比BaCO3的小
B.S没有毒性,C有毒性
C.BaSO4的密度大
D.胃酸能与C结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.3盐类水解的原理试卷(解析版) 题型:选择题
在一定条件下,Na2CO3溶液存在水解平衡:C+H2O HC+OH-。下列说法正确的是( )
HC+OH-。下列说法正确的是( )
A.稀释溶液,水解平衡常数增大
B.通入CO2,平衡向正反应方向移动
C.升高温度,减小
D.加入NaOH固体,溶液pH减小
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.3盐类水解的原理试卷(解析版) 题型:选择题
将0.1 mol下列物质置于1 L水中充分搅拌后,溶液中阴离子数最多的是( )
A.KClB.Mg(OH)2 C.Na2CO3D.MgSO4
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.2水的电离溶液的酸碱性(解析版) 题型:选择题
室温下,某溶液中由水电离产生的c(H+)等于10-13 mol·L-1,该溶液的溶质不可能是( )
A.NaHSO4B.NaCl C.HClD.Ba(OH)2
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.2.3 酸碱中和滴定(解析版) 题型:选择题
中和滴定实验中,标准NaOH溶液的浓度通常用H2C2O4·H2O为基准物质进行标定。基准物质必须具备的条件:①物质纯度要高,②相对分子质量较大,③性质稳定,如不易分解、不风化、不潮解、不跟空气中的CO2、O2等反应。实验室标定盐酸的浓度时,选择的基准物质最好是( )
A.NaOH B.NaHCO3 C.Na2CO3 D.Na2CO3·10H2O
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.1弱电解质的电离试卷(解析版) 题型:填空题
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如下图所示,请回答:

(1)“O”点导电能力为0的理由是 。
(2)A、B、C三点溶液c(H+)由小到大的顺序为 。
(3)若使C点溶液中c(CH3COO-)增大的同时溶液的c(H+)减小,可采取的措施是:
① ;② ;③ 。
(4)经实验测得C点处:c(CH3COOH)=0.1 mol·L-1,c(CH3COO-)=0.01 mol·L-1,则该条件下CH3COOH的电离常数Ka= 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学镁、铝及其化合物主要性质(解析版) 题型:填空题
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知:Cu2O+2H+=Cu+Cu2++H2O
(1)实验操作Ⅰ的名称为________;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有________(填仪器名称)。
(2)滤液A中铁元素的存在形式为________(填离子符号),生成该离子的离子方程式为____________________________________________,检验滤液A中存在该离子的试剂为________(填试剂名称)。
(3)金属单质E与固体混合物F发生的某一反应可用于焊接钢轨,该反应的化学方程式为__________________________________________________。
(4)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍。则两种溶液的pH=________。
(5)从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,涉及的主要步骤:称取一定质量的样品→________________→过滤、洗涤、干燥→称量剩余固体铜的质量。(填缺少的操作步骤,不必描述操作过程的细节)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com