
【题目】如图中A为电源,B为浸透饱和氯化钠溶液和酚酞溶液的滤纸,容器C为盛有500mL各0.1mol/L的CuSO4和K2SO4混合液的电解槽,e、f均为铂电极。接通电路后,发现B上的c点显红色,C中阳极产生1.12L(标况)气体,电解过程不考虑能量损失。

(1)电源A上的b为______极,滤纸B上d为______极。
(2)写出B上所发生的反应的化学反应方程式_________。
(3)写出C容器中阳极产生的气体是_______(填名称),另一极增重____克。
【答案】负 阳 2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑ 氧气 3.2
2NaOH+Cl2↑+H2↑ 氧气 3.2
【解析】
A为电源,B、C为电解池,接通电路后,发现B上的c点显红色,说明c是阴极,则d是阳极,e、f分别是电解池C的阳极、阴极;a、b分别是电源的正极、负极。
(1)原电池中与电源负极相连的一极为阴极;接通电路后,发现B上的c点显红色,说明c是阴极,滤纸B上d为阳极,电源A上的b为负极。
(2)B上用惰性电极电解饱和氯化钠溶液,生成氢气、氯气和氢氧化钠,发生的反应的化学反应方程式是2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。
(3)C容器中阳极发生的反应是4OH—-4e-=2H2O+O2↑,所以产生的气体是氧气,生成1.12L(标况)氧气转移0.2mol电子,硫酸铜的物质的量是0.5L×0.1mol/L=0.05mol,则根据电子得失守恒可知阴极先后发生反应Cu2++2e-=Cu、2H++2e-=H2,所以阴极增重0.05mol×64g/mol=3.2g。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】室温下,用0.10mol·L-1盐酸分别滴定20.00mL 0.10 mol·L-1氢氧化钾溶液和氨水,滴定过程中溶液pH随加入盐酸体积V(HCl)的变化关系如图。下列说法不正确的是( )

A. Ⅱ表示的是滴定氨水的曲线
B. 当pH=7时,滴定氨水消耗的V(HCl)<20mL,且此时溶液中c(NH4+)=c(Cl-)
C. 滴定氢氧化钾溶液时,若V(HCl)>20mL,则可能c(Cl-)>c(H+)>c(K+) >c(OH-)
D. 当滴定氨水消耗V(HCl)=10mL时,c(NH3H2O)>c(NH4+)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各化合物中,属于同系物的是_____,属于同分异构体的是____。
A.CH3CH2CH2CHO 与 ![]() B.
B.![]() 与
与 ![]()
C.![]() 与
与 ![]() D.
D.![]() 与
与 ![]()
E.![]() 与
与![]() F.戊烯与环戊烷
F.戊烯与环戊烷
(2) 用系统命名法命名下列物质:
①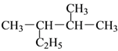 __________________; ②
__________________; ② ________________;
________________;
③(CH3)2C=CHCH=CH2 _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确且存在因果关系的是
选项 | 实验操作和现象 | 实验结论 |
A | 常温下,取浓度均为0.2mol/L的Na2CO3和NaHCO3溶液各2mL于试管中,分别滴加几滴酚酞试液,后者红色更深。 | 相同温度下,CO32-结合H+能力更强 |
B | 向Na2CrO4溶液中滴加浓硫酸,溶液由橙色变成黄色。 | 增大反应物浓度 平衡正向移动 |
C | 向硅酸钠溶液中通入CO2气体,溶液变浑浊 | 酸性:H2CO3>H2SiO3 |
D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,溶液变黄 | 氧化性:H2O2>Fe3+ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列互为同位素的是__________;互为同素异形体的是__________;(填序号)
①H2O与H2O2;②金刚石与石墨;③汞与水银;④16O和18O
(2)请写出以下物质或微粒的电子式:H2O__________NaCl__________。
(3)下面是同学们熟悉的物质:O2、HCl、Na2O、NH4Cl、NaOH。这些物质中,只含有离子键的是_________;(填化学式,下同)属于共价化合物的是______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构,受热易分解,层内的H3BO3分子通过氢键相连(如图所示),则下列有关说法中不正确的是
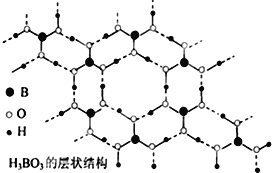
A. 正硼酸晶体属于分子晶体
B. 正硼酸分子的稳定性与氢键无关
C. 1molH3BO3晶体中含有3mol氢键
D. B原子杂化轨道的类型sp2,层间的H3BO3分子通过共价键相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,已知某三元弱酸H3A的三级电离平衡常数分别为![]() 、
、![]() 、
、![]() ,下列说法错误的是
,下列说法错误的是
A.Na3A的第一级水解平衡常数Kh1的数量级为10-2
B.在NaH2A溶液中:![]()
C.0.1mol/L的Na3A和0.1mol/L的Na2HA溶液中水电离程度,前者大于后者
D.向H3A溶液中加入NaOH溶液至中性时:c(Na+)=3c(A3-)+2c(HA2-)+c(H2A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列实验方案合理的是________。
A.配制银氨溶液:在一定量AgNO3溶液中,滴加氨水至沉淀恰好溶解
B.在检验醛基配制Cu(OH)2悬浊液时,在一定量CuSO4溶液中,加入少量NaOH溶液
C.验证RX为碘代烷,把RX与烧碱水溶液混合加热,将溶液冷却后再加入硝酸银溶液
D.无水乙醇和浓硫酸共热到170 ℃,将制得的气体通入酸性高锰酸钾,可检验制得的气体是否为乙烯
E.乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷
F.实验室制取乙烯时必须将温度计的水银球插入反应液中,测定反应液的温度
(2)写出D中制乙烯的化学方程式: _____________________________;
(3)欲除去混在苯中的少量苯酚,下列实验方法正确的是________(填序号)
A.分液 B.加入氢氧化钠溶液后,充分振荡,静置后分液
C.加入过量溴水,过滤 D.加入FeCl3溶液后,过滤
B中化学方程式: ____________________________;
C中化学方程式: ____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com