
| A、0.8 | B、1.1 |
| C、1.8 | D、2.2 |
| ||
| ||
| a |
| 2 |
| a |
| b |
| 1 |
| 2 |
| a |
| b |
| a |
| b |
| a |
| b |


科目:高中化学 来源: 题型:
| A、①②③⑤ | B、②③④ |
| C、①②④ | D、①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、仅用AgNO3溶液便可鉴别亚硝酸钠和食盐 |
| B、重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 |
| C、乙酸与乙醇的混合液可用分液漏斗进行分离 |
| D、可用10mL5mol.L-1的高锰酸钾溶液检验火柴燃烧后生成的气体中是否含有SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制银氨溶液时是将硝酸银溶液滴入到氨水中至不再生成沉淀为止 |
| B、容量瓶和中和滴定用的锥形瓶用蒸馏水洗净后立即使用,不会对实验结果造成误差 |
| C、检验二氧化硫气体中是否含有二氧化碳,可以将气体通入到饱和碳酸氢钠溶液中 |
| D、为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
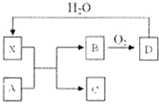 已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )| A、X使蔗糖变黑的现象主要体现了X的强氧化性 |
| B、若A为铁,则足量A与X在室温下即可完全反应 |
| C、若A为碳单质,则将C通入少量的澄清石灰水,一定可以观察到白色沉淀产生 |
| D、工业上,B转化为D的反应条件为450℃、常压、使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.0×10-7 mol?L-1 |
| B、0.1×10-7 mol?L-1 |
| C、5×10-8mol?L-1 |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水能电离出氢离子,故钢铁在潮湿环境中主要发生析氢腐蚀 |
| B、一个反应的焓变不仅与反应起始和最终状态有关,还与反应途径有关 |
| C、合成氨工业选择450℃高温主要是考虑提高化学反应速率,兼顾转化率 |
| D、醋酸溶液越稀,电离程度越大,故电离出的氢离子浓度越大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com