
【题目】黄铁矿主要成分是FeS2 。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。(M(FeS2)=120g/mol)
已知:SO2 + Fe3+ + H2O ——SO42- +Fe2+ + H+
Cr2O7 2-+ 6 Fe2+ + 14 H+ ==== 2 Cr3+ + 6 Fe3+ + 7 H2O
(1)将此方程式配平:_______________________________________________________________H+
(2)样品中FeS2的质量分数是(假设杂质不参加反应)________________。
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______________L,制得98%的硫酸 质量为__________ t 。
【答案】 SO2 +2 Fe3+ +2 H2O=SO42- +2Fe2+ +4 H+ 90% 3.36×106 15
【解析】(1)已知反应:SO2 + Fe3+ + H2O ——SO42- +Fe2+ + H+,根据反应中硫的化合价从+4价变为+6价,铁的化合价从+3价变为+2价,化合价升降总数的最小公倍数为2,结合电荷守恒和质量守恒进行配平得反应为:SO2 +2Fe3+ +2 H2O=SO42- +2Fe2+ +4 H+; (2)由反应4FeS2+11O2![]() 2Fe2O3+8SO2及离子反应方程式:SO2 +2Fe3+ +2 H2O=SO42- +2Fe2+ +4 H+、Cr2O7 2-+ 6 Fe2+ + 14 H+ ==== 2 Cr3+ + 6 Fe3+ + 7 H2O,可得下列关系式:
2Fe2O3+8SO2及离子反应方程式:SO2 +2Fe3+ +2 H2O=SO42- +2Fe2+ +4 H+、Cr2O7 2-+ 6 Fe2+ + 14 H+ ==== 2 Cr3+ + 6 Fe3+ + 7 H2O,可得下列关系式:
FeS2 ~ 2SO2 ~ 4Fe2+ ~![]() Cr2O72-
Cr2O72-
120g ![]() mol
mol
m(FeS2) 25.00×10-3 L×0.02000 mol·L-1
解得m(FeS2)=0.0900g
所以w(FeS2)= ![]() ×100%=90.00%
×100%=90.00%
(3) 4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
4×120t 8×22.4×103L
10t×90% V(SO2)
解得:V(SO2)=3.36×106L
又由2SO2+O2![]() 2SO3,及SO3+H2O=H2SO4得:
2SO3,及SO3+H2O=H2SO4得:
FeS2 ~ 2H2SO4
120 2×98
10t×90% m(H2SO4) ×98%
解之得m(H2SO4)=15t。


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】“即食即热型快餐”适合外出旅行时使用.其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( ) 
A.氢氧化钡晶体和氯化铵晶体
B.生石灰与水
C.金属钠与水
D.氯化钠与水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中列出了10种元素在周期表中的位置,按要求完成下列各小题.
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ⑥ | ⑦ | ⑨ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | ||||
4 | ② | ④ |
(1)化学性质最不活泼的元素的原子结构示意图为 .
(2)元素⑧的名称为 , 其最高价氧化物的水化物的化学式为 .
(3)元素③与元素⑧形成的化合物的电子式为 .
(4)非金属性最强的元素是(填元素符号);除0族外原子半径最大的元素是(填元素符号);元素①单质与水反应的离子方程式是 .
(5)①、③、⑤三种元素的最高价氧化物为水化物中,碱性最强的化合物的化学式是 .
(6)能形成两性氢氧化物的元素是(用元素符号表示),写出该元素的单质与①的最高价氧化物的水化物反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)990C时,Kw=1.0×10-12mol2·L-2,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为______________________.
②该温度下,将0.01 mol· L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH均为1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气______(填字母)
A.盐酸多 B.H2A多 C.一样多 D.无法确定
(2)最新研究发现,用隔膜电解法处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O![]() CH3CH2OH +CH3COOH实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
CH3CH2OH +CH3COOH实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
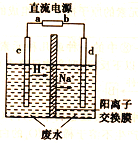
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入_______(填化学式),电极反应式为_______。
②在实际工艺处理中,阴极区乙醛的去除率可达80%。若在两极区分别注入1m3乙醛含量为3000mg·L-1的废水,可得到乙醇_____kg(计算结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL0.1mol/LA1C13 溶液,两烧杯中都有沉淀生成。下列判断正确的是( )
A. 甲中沉淀一定比乙中多 B. 乙中沉淀可能比甲中的多
C. 甲中沉淀一定比乙中的少 D. 甲中和乙中的沉淀可能一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】云南特色小吃“过桥米线”做法如下:先用滚沸的鸡汤一碗,上罩浮油,再辅以切得极薄的生肉片、乌龟片、火腿片、葱头等,最后把主料米线放入拌食即成。“过桥米线”汤鲜、肉嫩、料香、米线滑润,吃起来别有一番风味。以下有关“过桥米线”的说法不正确的是( )
A.上层浮油沸点较高,难以挥发
B.浮油对下层汤水起到很好的“液封”作用,使下层汤水及热量难以外逸
C.去掉上面的一层浮油,将减弱“过桥米线”的保温效果
D.上层浮油高温水解即产生美味的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.钢铁发生析氢腐蚀时,负极电极反应是Fe-2e-===Fe2+
B.铜制品和钢铁制品一样能发生析氢腐蚀
C.常温下钢铁在浓硝酸溶液中不会发生析氢腐蚀
D.钢铁发生析氢腐蚀时,H+得电子释放出H2,钢铁被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯气的叙述中,正确的是( )
A.氯气以液态形式存在时可称为氯水或液氯
B.红热的铜丝在氯气中燃烧,冒蓝色烟
C.有氯气参加的化学反应必须在溶液中进行
D.钠在氯气中燃烧生成白色固体氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被称为人体冷冻学之父的罗伯特·埃廷格在1962年写出《不朽的前景》一书。他在书中列举了大量事实,证明了冷冻复活的可能。比如,许多昆虫和低等生物冬天都冻僵起来,春天又自动复活。下列结论中与上述信息相关的是( )
A.化学反应前后质量守恒B.低温下分子无法运动
C.温度降低,化学反应停止D.温度越低,化学反应越慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com