
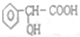
 .
. 分析 (1)该物质中官能团是醇羟基和羧基;
(2)该物质中含有醇羟基、羧基和苯环,具有醇、羧酸和苯的性质;
(3)能和Na反应的有醇羟基和羧基,且醇羟基、羧基与Na反应的物质的量之比为1:1,生成的氢气物质的量与醇羟基或羧基的物质的量之比为1:2;只有羧基能和碳酸钠反应生成二氧化碳,且羧基与生成的二氧化碳物质的量之比为2:1;
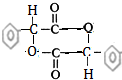
(4)该物质中含有醇羟基和羧基,2分子的A之间发生酯化反应生成2分子水生成3个六元环的酯.
解答 解:(1)该物质中官能团是醇羟基和羧基,故答案为:醇羟基和羧基;
(2)该物质中含有醇羟基、羧基和苯环,具有醇、羧酸和苯的性质,醇羟基能发生氧化反应、取代反应、酯化反应,羧基能发生中和反应、取代反应、酯化反应,苯环能发生加成反应和取代反应,因为含有羧基和醇羟基而能发生缩聚反应,故选ABD;
(3)能和Na反应的有醇羟基和羧基,且醇羟基、羧基与Na反应的物质的量之比为1:1,生成的氢气物质的量与醇羟基或羧基的物质的量之比为1:2;只有羧基能和碳酸钠反应生成二氧化碳,且羧基与生成的二氧化碳物质的量之比为2:1,取等量的A分别和足量钠、碳酸钠反应生成氢气和二氧化碳的体积之比为2:1,即V1:V2=2:1,
故答案为:V1:V2=2:1;
(4)该物质中含有醇羟基和羧基,2分子的A之间发生酯化反应生成2分子水生成3个六元环的酯,其结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查学生分析推断及计算能力,注意羧基与足量碳酸钠或碳酸氢钠反应生成的二氧化碳的物质的量之比差别,题目难度不大.


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:推断题
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D | 室温下其单质为淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E | 它在地壳中储量丰富,是人体不可缺少的微量元素之一.其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | V (Na2CO3)/mL | 沉淀情况 | 编号 | 反应温度/℃ | 沉淀情况 | |
| 1 | 2.8 | 多、蓝色 | 1 | 40 | 多、蓝色 | |
| 2 | 2.4 | 多、蓝色 | 2 | 60 | 少、浅绿色 | |
| 3 | 2.0 | 较多、绿色 | 3 | 75 | 较多、绿色 | |
| 4 | 1.6 | 较少、绿色 | 4 | 80 | 较多、绿色(少量褐色) |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除①③⑤外 | B. | 除②④外 | C. | 除①⑥⑦外 | D. | 除②④⑦外 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸钠与碳酸氢钠的混合溶液逐滴滴入盐酸溶液,立即产生大量气泡 | |
| B. | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明该溶液中有SO42- | |
| C. | 常温下,向0.1mol/L NaF和pH=12 NaOH的混合溶液中,滴加MgCl2溶液,先生成 MgF2沉淀(已知K[Mg(OH)]2=7.4×10-11 K( MgF2)=5.6×10-12) | |
| D. | 向 Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,则溶液变黄,说明氧化性H2O2>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入金属钠:Na+H2O═Na++OH-+H2↑ | |
| B. | 用NaOH溶液检验NH4Cl溶液中的铵根离子:NH${\;}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- | |
| D. | 用食醋除去水瓶中的水垢:CO${\;}_{3}^{2-}$+2CH3COOH═2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与氧气 | B. | 氢氧化钠与二氧化碳反应 | ||
| C. | 氧化钠与水反应 | D. | 木炭(C)和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl+NaOH═NaCl+H2O△H<0 | |
| B. | 2CH3OH(l)+3O2(g)$\stackrel{点燃}{→}$2CO2(g)+4H2O(l)△H<0 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H<0 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com