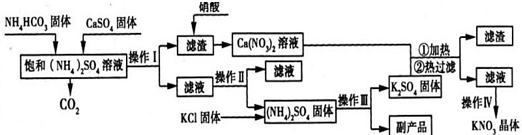
(2009?江门一模)氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业.该物质是微溶于水的白色固体,露置于空气中易被氧化为绿色的碱式氯化铜(Cu
2(0H)
3Cl),在热水中易水解生成氧化铜水合物而呈红色.以下是一种采用亚硫酸盐还原法,从含铜电镀废水中制备氯化亚铜的工艺流程如图1.

已知Ksp:CuCl:1.2×10
-4 CuOH:1.4×10
-15 Cu (OH)
2:1.6×10
-10请回答以下问题:
(1)写出反应①制备氯化亚铜的离子反应方程式:
2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+
2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+
.
(2)为提高CuCl的产率,常在反应①的体系中加入稀碱溶液,调节pH至3.5.这样做的目的是
OH-中和了反应中的H+,有利于平衡向右进行,提高CuCl的产率.但当OH-浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜,从而降减了CuCl的产率
OH-中和了反应中的H+,有利于平衡向右进行,提高CuCl的产率.但当OH-浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜,从而降减了CuCl的产率
.
(3)图2是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图2可知,溶液温度控制在
60℃
60℃
时,CuCl产率能达到94%,随后随温度升高CuCl产率会下降,其原因是
温度过高,一是促进了CuCl的水解,二是促进了CuCl与空气中氧气发生反应
温度过高,一是促进了CuCl的水解,二是促进了CuCl与空气中氧气发生反应
.
(4)若要提高Cucl的产率你认为还可采取的措施有
反应①在隔绝空气条件下进行
反应①在隔绝空气条件下进行
.
(5)写出氯化亚铜在空气中被氧化的化学方程式
4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl
4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl
.
(6)反应①也可用铁代替亚硫酸钠,写出该反应的化学方程式
2CuSO4+2NaCl+Fe=2CuCl+FeSO4+Na2SO4
2CuSO4+2NaCl+Fe=2CuCl+FeSO4+Na2SO4
.



 阅读快车系列答案
阅读快车系列答案
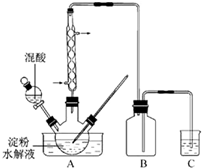 (2011?江苏)草酸是一种重要的化工产品.实验室用硝酸氧化淀粉水解液制备草酸的装置如图14所示(加热、搅拌和仪器固定装置均已略去)
(2011?江苏)草酸是一种重要的化工产品.实验室用硝酸氧化淀粉水解液制备草酸的装置如图14所示(加热、搅拌和仪器固定装置均已略去)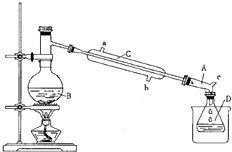 溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如下:
溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如下: