
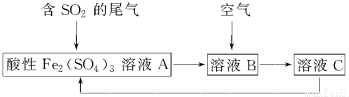
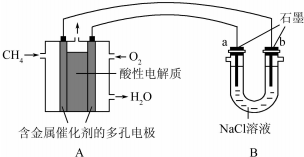
| A. | 溶液B中发生的反应为2SO2+O2═2SO3 | |
| B. | 可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+ | |
| C. | 由以上流程可推知氧化性:Fe3+>O2>SO42- | |
| D. | 此工艺的优点之一是物质能循环利用 |
分析 依据处理二氧化硫气体的工艺流程,各步反应都是完全反应,尾气中的二氧化硫气体,通入酸性硫酸铁溶液中发生氧化还原反应,三价铁离子氧化二氧化硫为硫酸,本身被还原为B溶液含有二价铁离子,通入空气会氧化亚铁离子得到含三价铁离子的溶液C,溶液C可以循环运用.
解答 解:A、溶液B中发生的反应是亚铁离子被氧气氧化为三价铁离子的反应:4Fe2++O2+4H+=4Fe3++2H2O,故A错误;
B、酸性高锰酸钾与铁离子不能反应,故B错误;
C、由反应可知:2Fe3++2H2O+SO2=2Fe2++SO42-+4H+;4Fe2++O2+4H+=4Fe3++2H2O;依据氧化还原反应中氧化剂的氧化性大于氧化产物,所以氧化性O2>Fe3+>SO42-,故C错误;
D、过程中生成的硫酸铁溶液可以循环使用,故D正确;
故选D.
点评 本题考查了污染气体二氧化硫的回收利用工艺流程的分析判断,氧化还原反应的规律应用,主要是考查二氧化硫的还原性、三价铁离子的氧化性、二价铁离子的还原性的性质应用,注意反应的产物判断是本题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应中熵变小于0、焓变大于0 | |
| B. | 判断反应能否自发进行需要根据△H与△S综合考虑 | |
| C. | 该反应是吸热反应,因此一定不能自发进行 | |
| D. | 碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
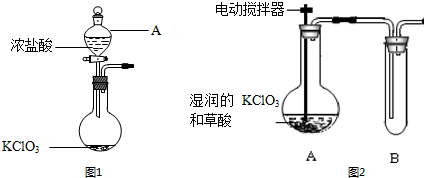

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
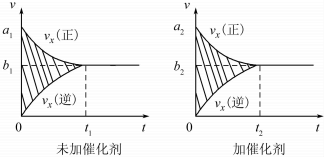
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

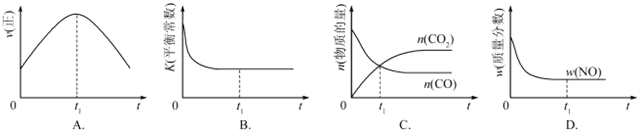
| A. | 图①表示将SO2气体通入溴水中溶液PH值随SO2气体变化关系 | |
| B. | 图②表示反应N2(g)+3H2($?_{催化剂}^{高温、高压}$g)2NH3(g)△H<0的平衡常数K随温度的变化 | |
| C. | 图③中阴、阳两极收集到的气体体积之比一定为1:1 | |
| D. | 图④中的△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当△H为“-”时,表示该反应为吸热反应 | |
| B. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 | |
| C. | H2S的燃烧热△H=-a kJ•mol-1,则表示H2S燃烧热的热化学方程式为2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H=-2a kJ•mol-1 | |
| D. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
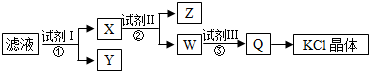
| A. | 图示的步骤中必需要经过2次过滤操作 | |
| B. | 起始滤液呈中性 | |
| C. | 试剂Ⅱ为Na2CO3溶液 | |
| D. | 试剂Ⅲ为盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com