
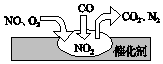
 随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )| A. | 反应中NO为氧化剂,N2为氧化产物 | |
| B. | 汽车尾气的主要污染成分包括CO、NO和N2 | |
| C. | NO和O2必须在催化剂表面才能反应 | |
| D. | 催化转化总化学方程式为2NO+O2+4CO=4CO2+N2 |
分析 汽车尾气的有害气体主要是氮氧化物、一氧化碳等,根据图片知,NO2在整个过程中是一种中间产物,一氧化氮气体和氧气、一氧化碳会在催化剂表面发生反应,转化为无毒气体,从而起到尾气净化作用.
解答 解:A.该反应中,NO生成为N2,N元素化合价降低,则NO是氧化剂,N2是还原产物,故A错误;
B.有毒的气体对环境有污染,CO、NO都是有毒物质,所以汽车尾气的主要污染成分是CO和NO,无N2,故B错误;
C.在空气中,一氧化氮和氧气反应生成二氧化氮,故C错误;
D.该反应的反应物是NO、O2、CO,生成物是CO2、N2,反应条件是催化剂,所以该反应方程式2NO+O2+4CO=4CO2+N2,故D正确;
故选D.
点评 本题主要考查汽车尾气的成分、生成、催化净化原理和反应条件应用,难度不大,只需读懂图就可完成,培养了学生分析问题和解决问题的能力.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:解答题
| Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 8.1 | 6.5 | 1.9 |
| 完全沉淀时 | 10.1 | 8.5 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W<X<Y<Z | |
| B. | 简单氢化物的稳定性X>Y>Z | |
| C. | W、X、Y形成的化合物抑制水的电离 | |
| D. | m的分解产物中p为氧化产物,q为还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素C、D、E的最高价氧化物对应水化物的酸性递减 | |
| B. | 元素D、E分别与元素A形成化合物的稳定性:A2D>AE | |
| C. | D、E简单离子的还原性顺序为:D>E | |
| D. | 元素B、D、E的简单离子半径大小为:B>D>E |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.2mol•(L•s)-1 | B. | v(C)=0.5 mol•(L•s)-1 | ||
| C. | v(B)=0.6 mol•(L•s)-1 | D. | v(D)=0.3 mol•(L•s)-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com