
| ||
| 2.24L |
| 22.4L/mol |
| 1mol×1g |
| 1g |
| ||
| 2.1mol |
| 0.115L |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知:N2(g)+2O2(g)=2NO2(g)△H=+68kJ?mol-12C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1则4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=+1200kJ?mol-1 | ||||||||||||
| B、由H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ?mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ | ||||||||||||
C、通常人们把拆开1 mol气态物质中某种共价键需要吸收的能量看成该共价键的键能
| ||||||||||||
| D、NH4HCO3(s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ?mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
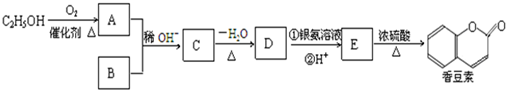
 (R、R′为烃基)
(R、R′为烃基)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、①③⑤⑥ |
| C、①③④⑥ | D、②③④⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com