
分析 (1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;再结合元素守恒,可知未知物是水,配平各物质的系数;
(2)根据HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各有一半;
(3)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,据此计算转移电子物质的量.
(4)根据离子方程式的书写方法来回答;
(5)1molCl2可以获得2mol电子,1molClO2可以获得电子5mol电子;
(6)反应的方程式为:6NO2+8NH3=7N2+12H2O,根据化合价的变化判断电子转移的方向和数目,根据化学方程式以及经还原得到的N2比经氧化得到的N2多2.8g,利用差量法计算原反应的NO2的物质的量.
解答 解:(1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;所以KClO3系数为2,KCl系数为2,HCl系数为4,结合元素守恒,可知未知物是水,水的系数是2,其反应方程式为:
2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O,电子转移如下: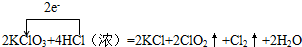
故答案为:2;4;2;2;1;2;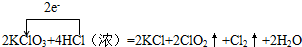 ;
;
(2)反应2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各有一半,
故选:B;
(3)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,所以产生0.1molCl2,转移的电子的物质的量为0.1mol×2=0.2mol,
故答案为:0.2mol;
(4)该反应的离子方程式为2ClO3-+4H++2Cl-=2ClO2↑+Cl2↑+2H2O,故答案为:2ClO3-+4H++2Cl-=2ClO2↑+Cl2↑+2H2O;
(5)设质量都是71g,氯气得到的电子数为 $\frac{71g}{71g/mol}$×2×1=2mol,
ClO2得到的电子数为 $\frac{71g}{67.5g/mol}$×1×5=$\frac{71}{13.5}$mol,
则ClO2消毒的效率是Cl2的倍数为 $\frac{\frac{71}{13.5}}{2}$≈2.63,
故答案为:2.63.
(6)反应中NO2中N元素的化合价由+1价降低到0价,得电子,NH3中N元素的化合价由-3价升高到0价,失电子,氧化还原反应氧化剂和还原剂得失电子数目相等,则反应的方程式为:6NO2+8NH3=7N2+12H2O,6molNO2参加反应被还原生成3molN2,8molNH3被氧化生成4molN2,氧化产物与还原产物的质量等于物质的量比,是4:3,
6NO2+8NH3=12H2O+7N2 △m(氧化得到的N2与还原得到的N2的质量差)
6×46 8×17 28
m(NO2) m(NH3) 2.8g
m(NO2)=$\frac{6×46×2.8g}{28}$=27.6 g,m(NH3)=$\frac{8×17×2.8g}{28}$=13.6g,
故答案为:4:3;27.6;13.6.
点评 本题考查氧化还原反应基本概念、配平、计算等,难度中等,判断氧化产物、还原产物是关键,注意同种元素反应氧化还原反应价态归中不交叉原则,难点是(5)题,根据转移电子相等进行计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题



 .写出A与溴水的反应方程式
.写出A与溴水的反应方程式 +3Br2→
+3Br2→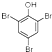 ↓+3HBr
↓+3HBr 或
或 (任写一个).
(任写一个). .
. 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 | |
| B. | 在一定条件下可实现下列转化MgCl2(溶液)→Mg(OH)2→MgO | |
| C. | 通过置换反应可实现由Mg到MgO的转化 | |
| D. | 镁与稀硝酸反应的离子方程式为:Mg+2H+═Mg+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与氢氧化钾溶液反应 | B. | 稀盐酸与氢氧化钠溶液反应 | ||
| C. | 稀硝酸与氢氧化钠溶液反应 | D. | 硅酸与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法.
以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | σ键是由两个p电子“肩并肩”重叠形成的 | |
| B. | σ键和π键都是共价键,σ键比π键更稳定 | |
| C. | 乙烯分子中的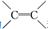 和乙炔分子中的-C≡C-都是π键 和乙炔分子中的-C≡C-都是π键 | |
| D. | H2分子中含有σ键,HCl分子中含π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com