
| A. | 加热 | B. | 投入金属钠 | C. | 加入NaHSO4固体 | D. | 以惰性电极电解 |
分析 A.加热促进水的电离;
B.Na与水反应生成NaOH;
C.加入NaHSO4固体,电离显酸性,氢离子浓度增大,但Kw不变;
D.惰性电极电解食盐水,生成NaOH、氢气、氯气.
解答 解:A.加热促进水的电离,则c(OH-)增大,故A不选;
B.Na与水反应生成NaOH,则c(OH-)增大,故B不选
C.加入NaHSO4固体,电离显酸性,氢离子浓度增大,但Kw不变,则c(OH-)减小,故C选;
D.惰性电极电解食盐水,生成NaOH、氢气、氯气,则c(OH-)增大,故D不选;
故选C.
点评 本题考查电离平衡,为高频考点,把握电离平衡移动、发生反应、Kw为解答的关键,侧重分析与应用能力的考查,注意水的电离平衡,题目难度不大.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/mol•L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
| A. | 20~40s内,v(N2O4)=0.004mol/(L•s) | |
| B. | 在相同条件下,开始时若向容器中充入的是0.80 molNO2,达到平衡后NO2的转化率为75% | |
| C. | 反应达平衡时,吸收的热量为15.9 kJ | |
| D. | 100 s时再通入0.40 mol N2O4,达新平衡时N2O4的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 事实或现象 | 结论 |
| A | 某钾盐中滴加盐酸,产生使澄清石灰水变浑浊的无色气体 | 该钾盐是K2CO3或KHCO3 |
| B | 由淀粉得到葡萄糖 | 发生了水解反应 |
| C | 常温下,向相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中的铝片先溶解完 | 反应物的浓度越大,反应速率越快 |
| D | NH3沸点低于PH3 | 结构和组成相似的物质,沸点随相对分子质量增大而升高 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
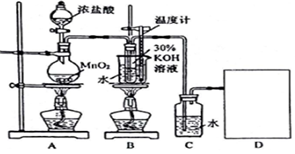
| 实验 编号 | 试剂及其用量 | |||
| 0.2mol•L-1kJ/mL | KClO3(s)/g | 6.0mol•L-1H2SO4/mL | H2O/mL | |
| 1 | 1.0 | 0.1 | 0 | a |
| 2 | 1.0 | 0.1 | 3.0 | b |
| 3 | 1.0 | 0.1 | 6.0 | c |
| 4 | 1.0 | 0.1 | 9.0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
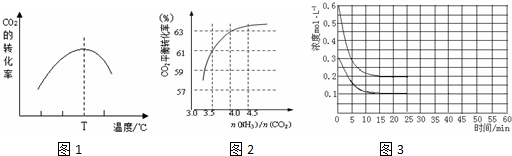
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加活性炭吸附水中小顆粒物,净化水质的方法属于物理方法 | |
| B. | 医用消毒洒精中乙醇的浓度为95% | |
| C. | 漂白粉长期放置会被空气中的氧气氧化而变质 | |
| D. | 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,“硝“是指硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
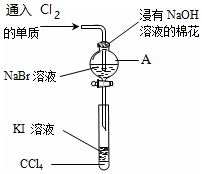 为了验证VIIA族部分元素非金属性递变规律,设计如图进行实验,
为了验证VIIA族部分元素非金属性递变规律,设计如图进行实验,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com