
| 1 |
| 3 |
| A、丙炔 | B、乙炔 | C、乙烯 | D、环丙烯 |
| 1 |
| 3 |
| 1 |
| 3 |
| 32g |
| 160g/mol |
| 4g |
| 0.1mol |


科目:高中化学 来源: 题型:
| A、在常温下,22.4L氧气所含的分子总数为NA |
| B、在标准状况下,NA个CO2分子与NA个H2SO4分子所占的体积之比为1:1 |
| C、在1mol Na2O2固体中,含有2NA个O22-离子 |
| D、在1L 0.1mol/L的碳酸钠溶液中,所含Na+的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水吸收少量的二氧化硫:NH3?H2O+SO2=NH4++HSO3- | ||||
B、用两个铜片作电极电解盐酸:Cu+2H+
| ||||
| C、钠与水反应:Na+2H2O=Na++2OH-+H2↑ | ||||
| D、铜与稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、足量的Fe在1molCl2中充分燃烧,转移的电子数为2NA |
| B、在标准状况下,11.2L NO与11.2L O2混合后其原子总数为2NA |
| C、在O℃101.1kpa条件下,22.4L的乙烷中含有共价键的数目为6NA |
| D、铜、锌和稀硫酸构成原电池,当转移电子数为NA时,产生气体的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO3通入水中:SO3+H2O=H2SO4 |
| B、Cl2通入FeCl2溶液中:Cl2+2FeCl2=2FeCl3 |
| C、HCl通入NaOH溶液中:HCl+NaOH=NaCl+H2O |
| D、CO2通入NaOH溶液中:CO2+2NaOH=Na2CO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 我国是世界上发现和使用铜及铜器最早的国家之一,直到现在铜及其化合物在工农业生产中仍然有着广泛的应用.
我国是世界上发现和使用铜及铜器最早的国家之一,直到现在铜及其化合物在工农业生产中仍然有着广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol羟基与17gNH3所含电子数都为NA |
| B、12.4g白磷(分子式为P4)中含有P-P共价键0.6NA |
| C、常温常压下,Na2O2与足量H2O反应,生成了0.2molO2,转移电子的数目为0.8 NA |
| D、适量铜粉溶解于1L0.5mol?L-1稀硝酸中,当生成2.24LNO时,溶液中氮原子数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、15.6 g Na2O2与过量CO2反应时,转移电子数为0.4NA |
| B、5.6 g Fe与过量硫粉反应,转移电子数为0.3NA |
| C、3.1 g白磷与红磷的混合物中所含磷原子数为0.1NA |
| D、某温度时,pH=6的纯水中含10-6NA个OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
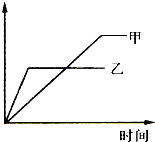 可用示意图表示的是( )
可用示意图表示的是( )| 反应 | 纵坐标 | 甲 | 乙 | |
| A |
2molSO2与1 molO2,在相同温度下2SO2+O2?SO3 | SO3的物 质的量 |
10个大 气压 |
2个大气 压 |
| B |
相同质量氨气,在同一容器中2NH3?N2+3H2;△H>0 | 氨气的 转化率 |
400℃ | 500℃ |
| C |
体积比1:3的N2、H2,在体积可变的恒压容器中N2+3H2?2NH3; | 氨气的浓度 | 活性高的 催化剂 |
活性一般 的催化剂 |
| D | 等质量钾、钠分别与水反应 | H2质量 | 钠 | 钾 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com