
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:阅读理解
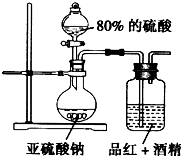 某研究性学习小组的同学决定通过实验探究SO2的漂白性是SO2本身具有的还是SO2与水作用的产物具有的,他们查阅资料知品红能溶解在酒精中形成红色溶液.
某研究性学习小组的同学决定通过实验探究SO2的漂白性是SO2本身具有的还是SO2与水作用的产物具有的,他们查阅资料知品红能溶解在酒精中形成红色溶液.- 3 |
2- 3 |
- 3 |
2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
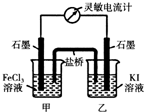
| 氯化铁溶液用量 | 10滴 | 20滴 | 30滴 | 2mL | 3mL | 4mL |
| 萃取后上层溶液颜色 | 黄色 | 黄色 | 黄色 | 较深黄色 | 黄色略带红色 | 黄红色 |
| 加入KSCN溶液后颜色 | 不变红 | 不变红 | 略变红 | 偏血红色 | 血红色 | 血红色 |
| c(I-)/mol?L-1 | c(Fe3+)/mol?L-1 | v/mol?L-1?s-1 | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
查看答案和解析>>
科目:高中化学 来源: 题型:
取2mL浓度为2×10-4mol/L的NaNO3溶液于试管,加入约4mL浓度为2mol/L的NaOH溶液,再加入适量铝粉,加热,用湿润的红色石蕊试纸检验产生的气体。实验中观察到试管中立即产生大量气泡,一段时间后试纸变蓝,铝粉溶解,溶液澄清不变色。请据以上实验事实分析:
(1)使湿润的红色石蕊试纸变蓝的气体是______________;
(2)写出NO3-发生反应的离子方程式,配平并填空。
Al + NO3-+ _______ + H2O → AlO2-+ _______ 氧化产物是____________
(3)为检验某含氮废水中是否含有NO3-,以废水水样2mL代替NaNO3溶液进行上述实验,现象相同,有同学认为无法据此得出“一定有NO3-”的结论,理由是废水中可能存在的_________________ (填离子符号)对实验结果有干扰;
(4)工业上利用铝粉除去含氮废水中的NO3-,当控制溶液pH在10.7左右时,所得产物中还有氮气。若氮气和氨气的体积比为4:1,则除去0.1mol NO3-,消耗铝______ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)取2mL浓度为2×10-4mol/L的NaNO3溶液于试管,加入约4mL浓度为2mol/L的NaOH溶液,再加入适量铝粉,加热,用湿润的红色石蕊试纸检验产生的气体。实验中观察到试管中立即产生大量气泡,一段时间后试纸变蓝,铝粉溶解,溶液澄清不变色。请据以上实验事实分析:
(1)使湿润的红色石蕊试纸变蓝的气体是______________;
(2)写出NO3-发生反应的离子方程式,配平并填空。
Al + NO3-+ _______ + H2O → AlO2-+ _______ 氧化产物是____________
(3)为检验某含氮废水中是否含有NO3-,以废水水样2mL代替NaNO3溶液进行上述实验,现象相同,有同学认为无法据此得出“一定有NO3-”的结论,理由是废水中可能存在的_________________ (填离子符号)对实验结果有干扰;
(4)工业上利用铝粉除去含氮废水中的NO3-,当控制溶液pH在10.7左右时,所得产物中还有氮气。若氮气和氨气的体积比为4:1,则除去0.1mol NO3-,消耗铝______ g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com