
| A. | ⑥③②④①⑤ | B. | ⑤④③①②⑥ | C. | ⑥③①②④⑤ | D. | ②③①④⑤⑥ |
科目:高中化学 来源: 题型:选择题
| A. | 加入适量6mol•L-1的盐酸 | B. | 加入少量醋酸钠固体 | ||
| C. | 加入少量铜粉 | D. | 加入少量金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q2<Q1<197 kJ•mol-1 | B. | Q2=Q1=197 kJ•mol-1 | ||
| C. | Q1<Q2<197 kJ•mol-1 | D. | Q2=Q1<197 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
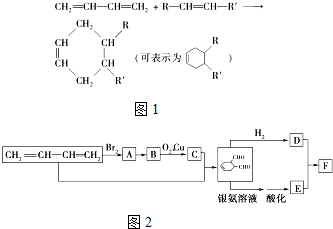
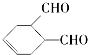 中含氧官能团的名称是醛基
中含氧官能团的名称是醛基 OHCCH=CHCHO+2H2O.
OHCCH=CHCHO+2H2O. .
. 、HC≡CCOOCH3.
、HC≡CCOOCH3.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
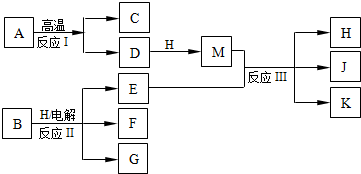
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,阴离子只能发生氧化反应 | |
| B. | 碳酸钠溶液显碱性:CO32-+2H2O?H2CO3+2OH- | |
| C. | 有些吸热反应不需要加热也能进行 | |
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Ca2+、Cl-、CO32- | B. | Cl-、ClO-、K+、H+ | ||
| C. | Na+、Fe3+、SO42-、OH- | D. | Na+、Cu2+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com