
【题目】用NA表示阿伏加德罗常数的数值。下列叙述正确的是
A.0.5 mol Mg在空气中完全燃烧生成MgO和Mg3N2时,转移的电子数为NA
B.7.8 g Na2O2与足量水反应时,转移的电子数为0.2NA
C.64 g CaC2固体中所含的阴、阳离子总数为3NA
D.密闭容器中充入1 mol H2与1 mol I2反应制备HI时,生成H-I键的数目为2NA
【答案】A
【解析】
A. 无论Mg转化成MgO还是转化成Mg3N2,Mg的化合价都是由0价→+2价,即0.5molMg在空气中完全燃烧生成MgO和Mg3N2时,转移电子物质的量为0.5mol×2=1mol,故A正确;
B. Na2O2与H2O反应2Na2O2+2H2O=4NaOH+O2↑,2molNa2O2与H2O反应转移2mol电子,即7.8g过氧化钠与H2O反应转移电子物质的量为![]() =0.1mol,故B错误;
=0.1mol,故B错误;
C. CaC2的电子式为![]() ,64gCaC2固体中含有阴、阳离子总物质的量为
,64gCaC2固体中含有阴、阳离子总物质的量为![]() =2mol,故C错误;
=2mol,故C错误;
D. H2和I2反应为可逆反应,根据题意,无法计算出生成H-I键的物质的量,故D错误;
答案:A。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】对氨基苯甲酸可用甲苯为原料合成。已知①苯环上的硝基可被还原为氨基:![]() +3Fe+6HCl→
+3Fe+6HCl→![]() +3FeCl2+2H2O,产物苯胺还原性强,易被氧化;②-CH3为邻、对位取代定位基,而-COOH为间位取代定位基。则由甲苯合成对氨基苯甲酸的步骤合理的是
+3FeCl2+2H2O,产物苯胺还原性强,易被氧化;②-CH3为邻、对位取代定位基,而-COOH为间位取代定位基。则由甲苯合成对氨基苯甲酸的步骤合理的是
A.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
B.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
C.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
D.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会发展息息相关,下列有关说法不正确的是
A.尼龙属于有机高分子材料
B.稻草秸秆和甘蔗渣中富含纤维素,可以用它来制造纸张
C.将大桥钢制构件用导线与石墨相连可以起到防腐的作用
D.刘禹锡![]() 浪淘沙
浪淘沙![]() 诗句“千淘万漉虽辛苦,吹尽黄沙始到金”中“淘”“漉”相当于“过滤”
诗句“千淘万漉虽辛苦,吹尽黄沙始到金”中“淘”“漉”相当于“过滤”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2与CH4可制得合成气:CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=+247 kJ·mol-1。初始温度均为T K时,在3个容器中按不同方式投入反应物,发生上述反应,相关信息如下表:
容器 | 起始物质的量/mol | CO2平衡转化率(α) | |||||
编号 | 容积/L | 条件 | CH4(g) | CO2(g) | CO(g) | H2(g) | |
Ⅰ | 2 | 恒温恒容 | 2 | 1 | 0 | 0 | 50% |
Ⅱ | 1 | 0.5 | 1 | 0 | 0 | ||
Ⅲ | 1 | 绝热恒容 | 1 | 0.5 | 0 | 0 | - |
下列说法正确的是
A.T K时,反应CH4(g)+CO2(g)2CO(g)+2H2(g)的平衡常数为1/3
B.容器Ⅱ中反应达到平衡时,α(CO2,Ⅱ)=50%
C.容器Ⅲ中反应达到平衡时反应热在123.5—247 kJ·mol-1范围内
D.容器Ⅱ中反应达到平衡时,再投入0.5 mol CH4、0.25 mol CO,反应达到新平衡前,v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是
A.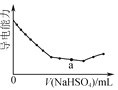 是Ba(OH)2溶液中滴加NaHSO4溶液之后,溶液的导电能力随滴入NaHSO4溶液体积变化的曲线,说明a点对应的溶液呈碱性
是Ba(OH)2溶液中滴加NaHSO4溶液之后,溶液的导电能力随滴入NaHSO4溶液体积变化的曲线,说明a点对应的溶液呈碱性
B. 表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
C.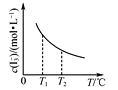 是I2+I-I3-中I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)<K(T2)
是I2+I-I3-中I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)<K(T2)
D.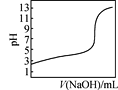 是室温下用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1某酸HX的滴定曲线,说明可用甲基橙判断该反应的终点
是室温下用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1某酸HX的滴定曲线,说明可用甲基橙判断该反应的终点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸。常温下,向H2C2O4溶液中逐滴加入NaOH溶液,混合溶液中lgX[X为 或
或 ]与pH的变化关系如图所示。下列说法一定正确的是
]与pH的变化关系如图所示。下列说法一定正确的是

A.Ⅰ表示lg 与pH的变化关系
与pH的变化关系
B.pH=1.22的溶液中:2c(C2O42—)+c(HC2O4—)>c(Na+)
C.1.22<pH<4.19的溶液中:c(HC2O4—)>c(C2O42—)>c(H2C2O4)
D.pH=4.19的溶液中:c(Na+)=3c(HC2O4—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol·L-1FeCl3溶液:Mg2+、Al3+、MnO4-、SCN-
B.能使紫色石蕊试液变蓝的溶液:Ca2+、Na+、ClO-、I-
C.0.1 mol·L-1 NH4HCO3溶液:Ba2+、K+、OH-、NO3—
D.![]() =10-12的溶液:NH4+、Na+、SO42-、Cl-
=10-12的溶液:NH4+、Na+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一固定容积的密闭容器中进行如下反应N2+3H2![]() 2NH3,下列情况一定能说明反应已达到平衡的是
2NH3,下列情况一定能说明反应已达到平衡的是
①容器内压强不随时间而变化
②单位时间内,有3molH2反应,同时有2molNH3生成
③气体的密度不随时间而变化
④单位时间内,有1molN2生成,同时有2molNH3生成
⑤用N2、H2、NH3表示的该反应的化学反应速率之比为1∶3∶2
⑥气体的平均摩尔质量不随时间而变化
A.①④⑥ B.①②③ C. ②③⑤ D.①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学设计实验制备亚氯酸钠![]() 并对其性质进行研究。
并对其性质进行研究。
实验Ⅰ:制取![]()
利用如图所示装置进行实验。
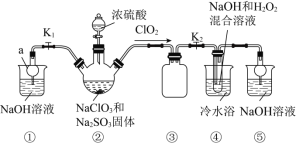
![]() 仪器a的名称是________,其作用是________。
仪器a的名称是________,其作用是________。
![]() 装置
装置![]() 发生的反应中氧化剂和还原剂的物质的量之比为________。
发生的反应中氧化剂和还原剂的物质的量之比为________。
![]() 装置
装置![]() 中制备
中制备![]() 的离子方程式为________。
的离子方程式为________。
![]() 用电解
用电解![]() 和
和![]() 的混合溶液也可以制备
的混合溶液也可以制备![]() ,阴极的电极反应式为________。
,阴极的电极反应式为________。
实验Ⅱ:研究![]() 的性质
的性质
![]() 利用所提供的试剂
利用所提供的试剂![]() 样品、
样品、![]() 溶液、KI溶液、稀硫酸、稀硝酸
溶液、KI溶液、稀硫酸、稀硝酸![]() 验证
验证![]() 的氧化性,并测定
的氧化性,并测定![]() 样品的纯度。
样品的纯度。
![]() 准确称取所得
准确称取所得![]() 样品
样品![]() 于烧杯中,加入适量蒸馏水和过量的________,再滴入适量的________,充分反应,反应的离子方程式为________。将所得混合液配成
于烧杯中,加入适量蒸馏水和过量的________,再滴入适量的________,充分反应,反应的离子方程式为________。将所得混合液配成![]() 待测溶液。
待测溶液。
![]() 移取
移取![]() 待测溶液于锥形瓶中,加几滴淀粉溶液,用
待测溶液于锥形瓶中,加几滴淀粉溶液,用![]() 标准液滴定,至滴定终点。重复2次,测得消耗标准液的平均体积为
标准液滴定,至滴定终点。重复2次,测得消耗标准液的平均体积为![]() 已知:
已知:![]() 。该样品中
。该样品中![]() 的质量分数为________
的质量分数为________![]() 保留一位小数
保留一位小数![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com