
分析 1-丙醇在浓硫酸作用下发生消去反应生成丙烯(CH3CH=CH2),由信息可知,丙烯在加热条件下发生取代反应生成A为CH2═CHCH2Cl,A与氯气发生加成反应可生成ClCH2CHClCH2Cl,ClCH2CHClCH2Cl在碱性条件下水解生成B为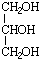 ,B与硝酸发生酯化反应可生成三硝酸甘油酯,据此解答.
,B与硝酸发生酯化反应可生成三硝酸甘油酯,据此解答.
解答 解:1-丙醇在浓硫酸作用下发生消去反应生成丙烯(CH3CH=CH2),由信息可知,丙烯在加热条件下发生取代反应生成A为CH2═CHCH2Cl,A与氯气发生加成反应可生成ClCH2CHClCH2Cl,ClCH2CHClCH2Cl在碱性条件下水解生成B为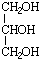 ,B与硝酸发生酯化反应可生成三硝酸甘油酯.
,B与硝酸发生酯化反应可生成三硝酸甘油酯.
(1)①为1-丙醇在浓硫酸作用下发生消去反应生成丙烯(CH3CH=CH2),化学反应方程式为CH3CH2CH2OH$→_{△}^{浓硫酸}$CH3CH=CH2+H2O,
②为丙烯(CH3CH=CH2)在加热条件下发生取代反应生成CH2═CHCH2Cl,化学反应方程式为CH2═CHCH3+Cl2$\stackrel{500℃}{→}$CH2═CHCH2Cl+HCl,
③为CH2═CHCH2Cl与氯气发生加成反应可生成ClCH2CHClCH2Cl,化学反应方程式为CH2═CHCH2Cl+Cl2→ClCH2CHClCH2Cl,
④为ClCH2CHClCH2Cl在碱性条件下水解生成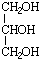 ,化学方程式为ClCH2CHClCH2Cl+3H2O$\stackrel{NaOH}{→}$HOCH2CHOHCH2OH+3HCl,
,化学方程式为ClCH2CHClCH2Cl+3H2O$\stackrel{NaOH}{→}$HOCH2CHOHCH2OH+3HCl,
⑤为甘油与硝酸发生酯化反应,反应方程式为: ;
;
如果所用1-丙醇中混有2-丙醇,发生消去反应都生成丙烯,对生成物的纯度没有影响,
答:②的产物为CH2═CHCH2Cl,④的产物为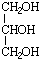 ;
;
①②③④⑤各步变化的化学方程式分别为:
CH3CH2CH2OH$→_{△}^{浓硫酸}$CH3CH=CH2+H2O,
CH2═CHCH3+Cl2$\stackrel{500℃}{→}$CH2═CHCH2Cl+HCl,
CH2═CHCH2Cl+Cl2→ClCH2CHClCH2Cl,
ClCH2CHClCH2Cl+3H2O$\stackrel{NaOH}{→}$HOCH2CHOHCH2OH+3HCl, ;
;
无影响,1-丙醇中和2-丙醇都发生消去反应生成丙烯.
点评 本题考查有机物的合成与推断、有机反应方程式书写等,综合考查学生的分析能力和化学知识的综合运用能力,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 钾原子的结构示意图为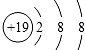 | B. | 水分子的结构式:H-O-H | ||
| C. | NH3的电子式为 | D. | NaOH的电子式为Na+[OH]- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
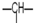 ,n3个-OH,其余为甲基.则甲基的个数为( )
,n3个-OH,其余为甲基.则甲基的个数为( )| A. | n1+n2+n3 | B. | 2n2+2n1-n3 | C. | n2+2-n3 | D. | 2n1+n2+2-n3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①④⑤ | C. | ①③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、乙炔、乙烯、丙烯 | B. | 苯、甲苯、己烷 | ||
| C. | CH3CHO、CH3COOH、CH3CH2OH | D. | C6H5OH、C6H5C2H5、C6H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的消耗量是3.0mol | |
| B. | N2的平均速率是0.5mol•(L•min)-1 | |
| C. | N2的平衡浓度是1.0mol•L-1 | |
| D. | N2反应的量占原物质的量的百分数是50% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
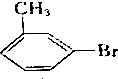 ,写出其同分异构体的结构简式:
,写出其同分异构体的结构简式: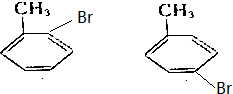 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中3个碳原子在同一直线上 | B. | 分子中所有原子在同一平面上 | ||
| C. | 与HCl加成只生成一种产物 | D. | 能与Cl2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com