
分析 两种原始溶液中各种盐的物质的量都相等,因而,溶解后得到的两种溶液中四种离子浓度完全相同,根据溶解度数据来确定析出的晶体.
解答 解:两种原始溶液中各种盐的物质的量都相等.
n(NaCl)=$\frac{23.4g}{58.5g/mol}$=n(KNO3)=$\frac{40.4g}{101g/mol}$=n(NaNO3)=$\frac{34.0g}{85g/mol}$=n(KCl)=$\frac{29.8g}{74.5g/mol}$=0.40mol,
因而,溶解后得到的两种溶液中四种离子浓度完全相同,根据溶解度数据,100℃时蒸发后得到的是NaCl晶体,冷却后得到的主要是KNO3,但也有少量的NaCl,m(′高温)=m(高温)=15.5g,m(′低温)=m(低温)=36.9g.
故答案为:KNO3和NaCl;100℃和10℃得到的晶体质量m′高温为15.5g,m′低温为36.9g
答:在100℃和10℃时析出晶体的质量分别为15.5g、36.9g.
点评 本题主要考查了溶解度的计算,难度不大,只要抓住23.4克NaCl和40.4克KNO3形成的溶液和34.0克NaNO3和29.8克KCl形成的溶液是一样的,就不必再计算就可得出答案.


科目:高中化学 来源: 题型:填空题
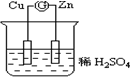 如图所示的原电池装置中,锌为负极,电极发生的是氧化反应(填氧化或还原),电极反应式为Zn-2e-=Zn2+;铜电极反应式为2H++2e-=H2↑,铜片上观察到的现象为有气泡产生.
如图所示的原电池装置中,锌为负极,电极发生的是氧化反应(填氧化或还原),电极反应式为Zn-2e-=Zn2+;铜电极反应式为2H++2e-=H2↑,铜片上观察到的现象为有气泡产生.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
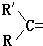 变成
变成 .现有某烯烃A,分子式为C4H8,被酸性高锰酸钾溶液氧化后不可能得到的产物是( )
.现有某烯烃A,分子式为C4H8,被酸性高锰酸钾溶液氧化后不可能得到的产物是( )| A. | CH3COOH | B. | CO2和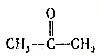 | ||
| C. | CO2和CH3CH2COOH | D. | HCOOH和CH3CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com