
【题目】根据题意解答
(1)某温度时,2L的密闭容器中X、Y、Z=种气体物质的量随时间的变化如图 所示. 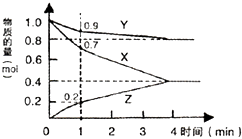
由图中数据分析,该反应的化学方程式为(用X、Y、Z表示),反应开始至1min,X的平均反应速率为 . 若4min时反应达到最大限度,Z的物质的量等于0.4 mol.此时,X的转化率为 , Y的物质的量浓度为
(2)可逆反应:2NO2(g)2NO(g)+O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是(填序号). ①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态.
【答案】
(1)3X+Y=2Z;0.15mol/(L.min);60%;0.4mol/L
(2)①④
【解析】解:(1)根据图像知,X、Y是反应物而Z是生成物,反应达到平衡状态时,参加反应的△n(X)=(1.0﹣0.4)mol=0.6mol、△n(Y)=(1.0﹣0.8)mol=0.2mol、△n(Z)=(0.4﹣0)mol=0.4mol,参加反应的各物质的量变化量之比等于其计量数之比,所以X、Y、Z计量数之比=0.6mol:0.2mol:0.4mol=3:1:2,该反应的化学方程式为3X+Y=2Z;X的反应速率= ![]() =
= ![]() =0.15mol/(L.min);4min时,反应达到平衡状态,Z的物质的量为0.4mol,根据X和Z的关系式知,参加反应的X的物质的量为0.6mol,转化率=
=0.15mol/(L.min);4min时,反应达到平衡状态,Z的物质的量为0.4mol,根据X和Z的关系式知,参加反应的X的物质的量为0.6mol,转化率= ![]() =
= ![]() =60%;根据Z和Y的关系式知,参加反应的Y的物质的量为0.2mol,则剩余Y的物质的量0.8mol,Y的物质的量浓度=
=60%;根据Z和Y的关系式知,参加反应的Y的物质的量为0.2mol,则剩余Y的物质的量0.8mol,Y的物质的量浓度= ![]() =
= ![]() =0.4mol/L, 所以答案是:3X+Y=2Z;0.15mol/(L.min);60%;0.4mol/L;(2)反应达到平衡状态时正逆反应速率相等,反应体系中各物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,①单位时间内生成nmolO2的同时生成2nmolNO2 , 正逆反应速率相等,反应达到平衡状态,故正确;②无论反应是否达到平衡状态,都存在单位时间内生成nmolO2的同时生成2nmolNO,所以不能据此判断平衡状态,故错误;③无论反应是否达到平衡状态,都存在用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态,不能据此判断平衡状态,故错误;④混合气体的颜色不再改变的状态,说明二氧化氮浓度不变,则反应达到平衡状态,故正确;⑤无论反应是否达到平衡状态,混合气体的密度始终不变,不能据此判断平衡状态,故错误;故选①④.
=0.4mol/L, 所以答案是:3X+Y=2Z;0.15mol/(L.min);60%;0.4mol/L;(2)反应达到平衡状态时正逆反应速率相等,反应体系中各物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,①单位时间内生成nmolO2的同时生成2nmolNO2 , 正逆反应速率相等,反应达到平衡状态,故正确;②无论反应是否达到平衡状态,都存在单位时间内生成nmolO2的同时生成2nmolNO,所以不能据此判断平衡状态,故错误;③无论反应是否达到平衡状态,都存在用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态,不能据此判断平衡状态,故错误;④混合气体的颜色不再改变的状态,说明二氧化氮浓度不变,则反应达到平衡状态,故正确;⑤无论反应是否达到平衡状态,混合气体的密度始终不变,不能据此判断平衡状态,故错误;故选①④.
【考点精析】认真审题,首先需要了解化学平衡状态的判断(状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等).


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组利用如图实验装置制备氯气并检验氯气的性质. 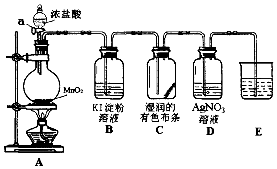
(1)仪器a 的名称是 .
(2)装置A中发生反应的离子方程式为 .
(3)下列说法不正确的是 .
A.装置B中溶液变蓝,说明氯的非金属性强于碘
B.装置C中布条褪色,说明氯气有强氧化性
C.装置D中产生白色沉淀,说明有HCl挥发出来
D.装置E中试剂可以是NaOH溶液,作用是吸收尾气.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律.
(1)甲同学在a、b、c三只烧杯里分别加入50mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象.甲同学设计实验的目的是;反应最剧烈的是 .
(2)乙同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图装置以验证氮、碳、硅元素的非金属性强弱. 乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,可与铜反应;B是块状固体;打开分液漏斗的活塞后,可看到有大量气泡D产生;烧杯中可观察到白色沉淀C生成.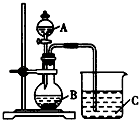
(i)写出下列物质的化学式:A、C、D .
(ii)写出烧杯中发生反应的离子方程式: .
(iii)碳、氮、硅三种元素的非金属性由强到弱顺序为 .
(iv)丙同学认为乙同学设计的实验不够严谨,应该在B和C之间增加一个洗气装置,该装置中应盛放(填试剂).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液.下列说法正确的是( )
A.电子由Zn电极流出,经KOH溶液流向正极
B.正极反应式为2FeO42﹣+10H++6e﹣=Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变
D.电池工作时OH﹣向负极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的键线式为:
(1)有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式:
(2)Y与乙烯在一定条件下发生等物质的量聚合反应,写出其反应的化学方程式:
(3)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有种. 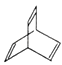
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(多选)碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,其结构如图.下列有关该物质的说法不正确的是( ) 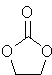
A.分子式为C3H2O3
B.分子中σ键与π键个数之比为3:1
C.分子中既有极性键也有非极性键
D.分子中碳原子的杂化方式全部为sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,101k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol.下列热化学方程式书写正确的是( )
A.2H+(aq)+SO42﹣(aq)+Ba2+(aq)+2OH﹣(aq)=BaSO4(s)+2H2O(1);△H=﹣57.3 kJ/mol
B.KOH(aq)+ ![]() H2SO4(aq)=
H2SO4(aq)= ![]() K2SO4(aq)+H2O(l);△H=﹣57.3kJ/mol
K2SO4(aq)+H2O(l);△H=﹣57.3kJ/mol
C.C8H18(l)+ ![]() ?O2(g)=8CO2(g)+9H2O(g);△H=﹣5518 kJ/mol
?O2(g)=8CO2(g)+9H2O(g);△H=﹣5518 kJ/mol
D.2C8H18(g)+25O2(g)=16CO2(g)+18 H2O(1);△H=﹣5518 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A只含有C,H,三种元素,16.8g该有机物经燃烧生成44.0g CO2和14.4g H2O2;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有C=O键和C=C键,核磁共振氢谱有三个峰,峰面积为6:1:1
(1)A的分子式是 . A的结构简式是;该分子中的含氧官能团的名称是 .
(2)下列物质中,一定条件能与A发生反应的;
A.H2
B.KMnO4
C.Br2
(3)该分子中在同一平面上的原子最多有个.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com