
| O2 |
| 催化剂/△ |
| H2O |
| NaOH |
| 盐酸 |
| 盐酸 |
| 电解 |
| O2 |
| △ |
| CO2 |
| A、②④ | B、③④ | C、①④ | D、①②③ |


科目:高中化学 来源: 题型:
| A、三氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | ||||
| B、向含有0.2 mol FeI2的溶液中通入0.25 mol Cl2:8I-+2Fe2++5Cl2═10Cl-+4I2+2Fe3+ | ||||
C、K37ClO3与浓盐酸(HCl)在加热时生成Cl2:37ClO3-+6HCl
| ||||
| D、将0.1 mol/L盐酸数滴缓缓滴入0.1 mol/L 25 mL Na2CO3溶液中,并不断搅拌:2H++CO32-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | I-的初始浓度 (mol?L-1) | OCl-的初始浓度 (mol?L-1) | OH-的初始浓度 (mol?L-1) | 初始速率v (mol?L-1?s-1) |
| 1 | 2×10-3 | 1.5×10-3 | 1.00 | 1.8×10-4 |
| 2 | a | 1.5×10-3 | 1.00 | 3.6×10-4 |
| 3 | 2×10-3 | 3×10-3 | 2.00 | 1.8×10-4 |
| 4 | 4×10-3 | 3×10-3 | 1.00 | 7.2×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 图中 A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3发生反应;C和D的相对分子质量相等,且E为无支链的化合物.根据图回答问题:
图中 A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3发生反应;C和D的相对分子质量相等,且E为无支链的化合物.根据图回答问题:| 实验编号 | C物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶的pH |
| m | 0.1 | 0.1 | pH=9 |
| n | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2O3可与水反应生成Al(OH)3 |
| B、铝是人类使用最早的金属之一 |
| C、Al2O3是碱性氧化物 |
| D、Al(OH)3沉淀可以溶于盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使pH试纸呈红色的溶液:Na+、[Al(OH)4]-、SO42-、Cl- |
| B、澄清透明溶液:Cr2O72-、SO42-、K+、NO3- |
| C、pH=0的溶液:Na+、C2O42-、MnO4-、SO42- |
| D、水电离产生的c(H+)=1×10-12mol?L-1的溶液:HCO3-、NH4+、C1-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
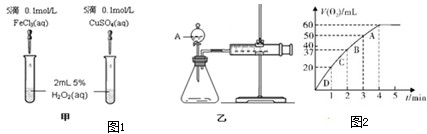
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com