
用离子方程式解释下列现象:
(1)将鸡蛋浸泡在食酸中,蛋壳变软,且有气泡生成:________.
(2)用自来水配制AgNO3溶液时,会出现浑浊,过滤得沉淀,向其中加入稀HNO3,沉淀不溶解:________;说明自来水中含有________(用离子表示).
(3)重金属离子具有毒性.已知甲、乙两厂均有含重金属离子的废液,甲厂废液经化验呈碱性,主要的有毒离子为Ba2+,乙厂废液中含有Cu2+、SO42-.若将甲、乙两厂的废液按一定比例混合,毒性明显降低:________.
|
答案: (1)2CH3COOH+CaCO3(2)Ag++Cl- (3)Ba2++2OH-+Cu2++SO42- 讲析:(1)鸡蛋壳的主要成分是CaCO3,能与食酸(主要成分是CH3COOH)反应生成可溶的(CH3COO)2Ca、CO2气体和水.(2)自来水一般要用氯气进行消毒,由于发生反应:Cl2+H2O 点评:生产、生活中的多数现象都与离子反应有关,解题的关键是找出将可能发生反应的物质,然后按书写要求写出正确的离子方程式. |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
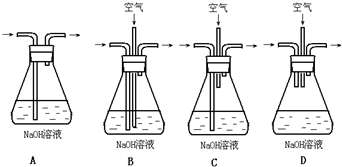
查看答案和解析>>
科目:高中化学 来源: 题型:
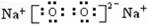
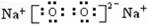
 HClO+H+
HClO+H+ HClO+H+
HClO+H+
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 Al(OH)3+3H+
Al(OH)3+3H+ Al(OH)3+3H+
Al(OH)3+3H+查看答案和解析>>
科目:高中化学 来源: 题型:
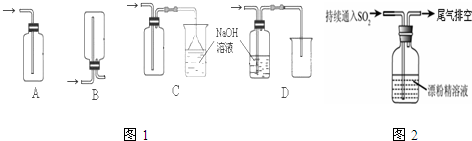
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com