
| A、0.1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价键数均为0.4NA |
| B、1L amol/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目为3NA |
| C、0.1 molN2和0.3molH2在一定条件下充分反应,转移电子数目为0.6NA |
| D、常温常压下,65gZn与足量浓 H2SO4充分反应,转移电子数一定为2NA |


科目:高中化学 来源: 题型:
A、一种镁电池的反应式为XMg+Mo3S4
| |||
| B、在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是NH4++Fe3++2SO42-+2Ba2++4OH-=2BaSO4↓+Fe(OH)3↓+NH3?H2O | |||
| C、在甲、乙两个体积不变且相同的密闭容器中发生反应A(g)+2B(g)?2C(g),初始条件均为:常温,A、B两气体各1mol.甲容器中的反应在常温下达平衡,此时气体压强为原来气体压强的80%,乙容器中的反应在200℃时达平衡,若此时气体A的体积分数为35% 则说明该反应是放热反应 | |||
| D、已知:N2(g)+2O2(g)=2NO2(g)△H=+68 kJ?mol-12C(s)+O2(g)=2CO(g)△H=-221 kJ?mol-1C(s)+O2(g)=CO2(g)△H=-393.5 kJ?mol-1则4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-1200 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中 含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO |
| 乙 | 既有Fe3+又有Fe2+ | 有SO |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
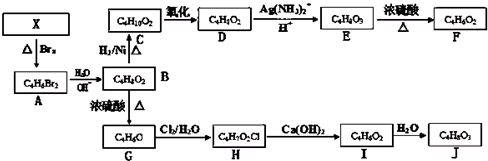
查看答案和解析>>
科目:高中化学 来源: 题型:
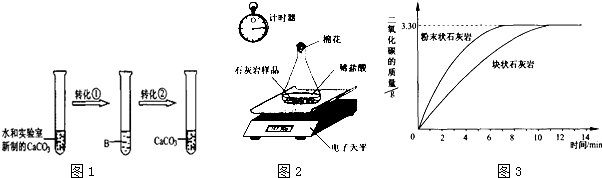
查看答案和解析>>
科目:高中化学 来源: 题型:
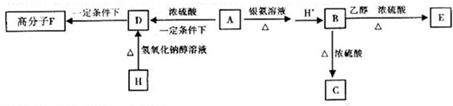
查看答案和解析>>
科目:高中化学 来源: 题型:
| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 石蕊 | (乙) |
| 待测氢氧化钠 | 0.100mol/L醋酸的体积 | ||
| 滴定次数 | 溶液的体积(mL) | 滴定前的刻度(mL) | 滴定后的刻度(mL) |
| 第一次 | 25.00 | 0.00 | 24.98 |
| 第二次 | 25.00 | 1.56 | 27.86 |
| 第三次 | 25.00 | 0.22 | 25.24 |
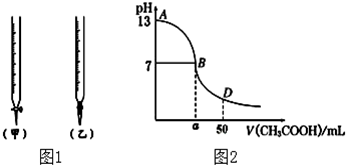
查看答案和解析>>
科目:高中化学 来源: 题型:
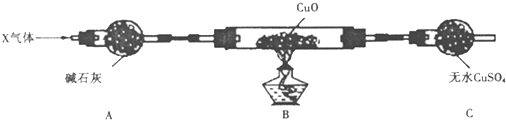
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com