
【题目】向500~600℃的铁屑中通入氯气生产无水氯化铁,现用如图所示的装置进行实验,下列说法正确的是
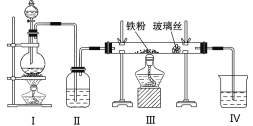
A.分液漏斗中盛放的试剂是稀盐酸
B.洗气瓶中盛放的试剂是饱和食盐水
C.应先点燃I中酒精灯,再点燃III中酒精灯
D.烧杯中盛放石灰水,目的是吸收尾气
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】硝酸铝广泛应用在显像管生产,稀土的提炼等,工业上具体流程如下:

已知:①硝酸铝白色透明结晶。易溶于水和乙醇,极微溶于丙酮,几乎不溶于乙酸乙酯。
②熔点73℃,在135℃时分解。
③硝酸和铝反应的还原产物分布如图1。

某兴趣小组在实验室制取硝酸铝,请回答:
(1)从工业生产角度考虑稀硝酸的最佳浓度范围为________ mol·L-1。反应2中的离子方程式____________。
(2)下列说法合理的是________。
A 反应1中加入的NaOH溶液,除油污和氧化膜,所以要足量
B 没有真空,也可在水浴条件下蒸发,防止Al(NO3)3的分解
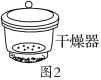
C Al(NO3)3·9H2O干燥时,可放在如图2的干燥器中,隔板下放上浓硫酸吸水,由于吸附力较大,要用力垂直拉开玻璃盖
D 制取后的Al(NO3)3必须密封保存
(3)Al(NO3)3·9H2O也可以和SOCl2反应,除了生成Al(NO3)3,其它产物都是酸性气体,有关的方程式是______________;
(4)由铝制备Al(NO3)3的装置如图3:
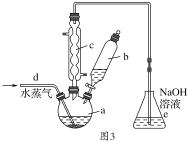
①通入水蒸气的作用是提高温度和________。
②e中很难除尽尾气,理由是_______________, Al(NO3)3·9H2O晶体吸附HNO3,合适的洗涤剂是________。
③有人认为C的冷凝管是多余的,他提供的理由可能是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为2H2+O2═2H2O,下列有关说法正确的是( )
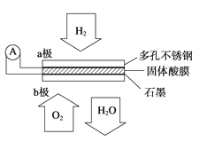
A. 电流通过外电路从a极流向b极
B. b极上的电极反应式为O2+2H2O+4e-═4OH-
C. 每转移0.2 mol电子,在负极上消耗标况下1.12 L的O2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
有机物F是有机合成工业中一种重要的中间体。以甲苯和丙烯为起始原料合成F的工艺流程如下:

回答下列问题:
(1)化合物B中含氧官能团名称是_________F的结构简式__________________
(2)写出C与银氨溶液共热的化学反应方程式:_______________________
(3)化合物D不能发生的反应有__________________(填序号)。
①加成反应②取代反应③消去反应④氧化反应⑤水解反应
(4)B的含苯环结构的同分异构体还有__________种,其中一种的核磁共振氢谱中出现4个峰且不与FeCl3溶液发生显色反应的是____________(填结构简式)。
(5)B与D发生反应的类型________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)![]() 2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1。下列有关说法正确的是
2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1。下列有关说法正确的是
①用A表示的反应速率是0.4 mol·L-1·min-1
②在2 min末时,反应物B的反应速率是0.3 mol·L-1·min-1
③在这2 min内用C表示的平均速率为0.2 mol·L-1·min-1
④在2 min时,B、C、D的浓度比一定为3∶2∶1
⑤若D的起始浓度为0.1 mol·L-1,则2 min时D的浓度为0.3 mol·L-1
A. ①②③B. ②④C. ④⑤D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,发生可逆反应:![]() ,当m、n、p、q为任意整数时,反应达到平衡的标志是( )
,当m、n、p、q为任意整数时,反应达到平衡的标志是( )
①体系的压强不再改变 ②体系的温度不再改变 ③各组分的浓度不再改变 ④各组分质量分数不再改变 ⑤反应速率![]() ⑥单位时间内m mol A断键反应,同时p mol C也断键反应 ⑦体系的密度不再变化( )
⑥单位时间内m mol A断键反应,同时p mol C也断键反应 ⑦体系的密度不再变化( )
A.③⑤⑥B.②③④⑥C.①③④⑤D.④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿主要成分是氧化铝、氧化铁、二氧化硅等。从铝土矿中提炼氧化铝的流程如下:

下列说法正确的是( )
A.“滤渣”的成分是氢氧化铁
B.“沉淀”的成分是二氧化硅
C.“气体A”是足量的氨气
D.整个流程中铝元素的化合价没有发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到相应目的的是
A | B | C | D | |
目的 | 比较碳酸根与碳酸氢根水解程度 | 研究浓度对化学平衡的影响 | 比较不同催化剂对化学反应速率的影响 | 比较碳酸、醋酸和硼酸的酸性强弱 |
实验方案 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用50mL0.50mol/L盐酸、50mL0.55mol/LNaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
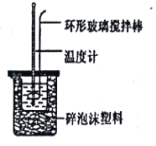
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.3 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 26.9 |
完成下列问题:
(1)根据上表中所测数据,该实验中和热△H=___。(不必计算和化简,代入数据即可)[盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g·℃)计算]。
(2)在该实验过程中,该同学需要测定的实验数据有___(填序号)。
A.盐酸的浓度 B.盐酸的温度
C.氢氧化钠溶液的浓度 D.氢氧化钠溶液的温度
E.水的比热容 F.反应后混合溶液的终止温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com