
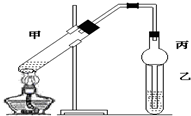
分析 甲中乙酸、乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯和水,丙中球形结构可防止液体倒吸,以此来解答.
解答 解:试管甲中乙酸、乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯和水,发生反应的化学方程式为CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O.乙醇、乙酸易溶于水,则该实验中球形管丙的作用是防止倒吸,
故答案为:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O;防止倒吸.
点评 本题考查有机物的结构与性质,为高频考点,把握乙酸和乙醇的性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意球形管的作用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 电子从3s能级跃迁到3p能级形成的光谱是发射光谱 | |
| B. | 白磷(P4)分子是正四面体结构,故分子中的键角为109°28′ | |
| C. | NO2- 中心原子采取sp2杂化,分子空间构型为“V”形 | |
| D. | 原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
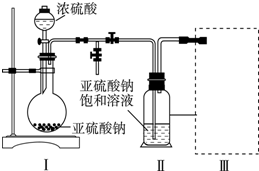
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
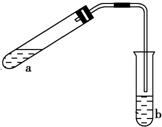 可用如图所示的装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:
可用如图所示的装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A是石油裂解主要产物之一,其产量常用于衡量一个石油化工发展水平的标志.
A是石油裂解主要产物之一,其产量常用于衡量一个石油化工发展水平的标志.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
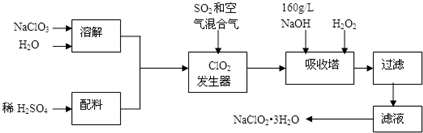
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③①④ | C. | ②①③④ | D. | ③②④① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g | B. | 16g | C. | 24g | D. | 32g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com