
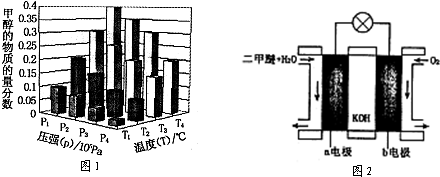
| 催化剂 |
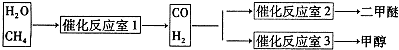
| 各生成物平衡浓度系数次幂之积 |
| 各反应物平衡浓度系数次幂之积 |
| 1 |
| 3 |
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| B、向某溶液中先滴加CaCl2溶液,产生白色沉淀,再滴加稀盐酸沉淀溶解并产生无色气体,该气体能使澄清石灰水变浑浊,则该溶液中一定有CO32- |
| C、液溴易挥发,存放液溴应加水封,并保存在棕色试剂瓶中 |
| D、向某溶液中先滴加BaCl2溶液,产生白色沉淀,再滴加稀盐酸白色沉淀不溶解,该溶液一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
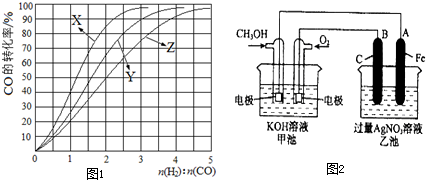
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
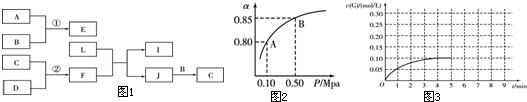
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、燃烧不一定有氧气参加 |
| B、只要有盐和水生成的反应就一定是中和反应 |
| C、一种单质和一种化合物发生的反应不一定是置换反应 |
| D、饱和溶液析出晶体后,剩余溶液中溶质的质量分数可能不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH3CHO+2Cu(OH)2
| |||
B、CH3CH2OH+CuO
| |||
C、2CH2═CH2+O2
| |||
| D、CH3CH2OH+HBr-→CH3CH2Br+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com