
【题目】右图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
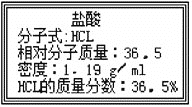
⑴该浓盐酸中HCL的物质的量浓度为 __________mol·L-1 。
⑵取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是(____)
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
⑶某学生欲用上述浓盐酸和蒸馏水配制500ml物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取________ml上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
I.用量筒量取浓盐酸进俯视观察凹液面(______)
II.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水(______)
【答案】11.9 BD16.8 (注意保留一位小数)BB
【解析】
(1)根据c=![]() 计算;(2)溶液是均匀的,溶液的密度、浓度不随体积变化;(3)根据稀释定律,稀释前后HCl的物质的量不变,据此计算需要浓盐酸的体积;分析操作对溶质物质的量、溶液体积的影响,根据c=
计算;(2)溶液是均匀的,溶液的密度、浓度不随体积变化;(3)根据稀释定律,稀释前后HCl的物质的量不变,据此计算需要浓盐酸的体积;分析操作对溶质物质的量、溶液体积的影响,根据c=![]() 判断对所配溶液浓度的影响。
判断对所配溶液浓度的影响。
(1)根据c=![]() 可知,该浓盐酸中HCl的物质的量浓度c=
可知,该浓盐酸中HCl的物质的量浓度c=![]() mol/L=11.9mol/L。(2)溶液是均一、稳定的混合物,所以取用任意体积的该盐酸溶液时,A、根据n=cV可知,溶液中HCl的物质的量与溶液的体积有关系,A不正确;B、溶液的浓度是不变的,总是11.9mol/L,B正确;C、溶液中Cl-的数目与氯化氢的物质的量有关系,因此与溶液的体积有关系,C不正确;D、溶液的密度是溶液的性质,与溶液的体积无关系,D正确,答案选BD。(3)①根据稀释过程中溶质的质量不变可知,配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸需要该浓盐酸的体积=
mol/L=11.9mol/L。(2)溶液是均一、稳定的混合物,所以取用任意体积的该盐酸溶液时,A、根据n=cV可知,溶液中HCl的物质的量与溶液的体积有关系,A不正确;B、溶液的浓度是不变的,总是11.9mol/L,B正确;C、溶液中Cl-的数目与氯化氢的物质的量有关系,因此与溶液的体积有关系,C不正确;D、溶液的密度是溶液的性质,与溶液的体积无关系,D正确,答案选BD。(3)①根据稀释过程中溶质的质量不变可知,配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸需要该浓盐酸的体积=![]() =0.0168L=16.8ml。②a.用量筒量取浓盐酸时俯视观察凹液面,则浓盐酸的偏小,因此所配溶液的浓度偏低,答案选B;b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,则溶液的体积增加,所以所配溶液的浓度偏低,答案选B。
=0.0168L=16.8ml。②a.用量筒量取浓盐酸时俯视观察凹液面,则浓盐酸的偏小,因此所配溶液的浓度偏低,答案选B;b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,则溶液的体积增加,所以所配溶液的浓度偏低,答案选B。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】关于物质分类的正确组合是( )
分类组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | 纯碱 | HCl | 烧碱 | 氧化铝 | 二氧化碳 |
B | 烧碱 | 硫酸 | 食盐 | 氧化镁 | 一氧化碳 |
C | 苛性钠 | 醋酸 | 碳酸铵 | 过氧化钠 | 二氧化硫 |
D | 苛性钾 | HCl | 小苏打 | 氧化钠 | 三氧化硫 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol/L的Na2SO3溶液300mL,恰好将2×10-2mol的XO4-离子还原,则元素X在还原产物中的化合价是
A.+1B.+2C.+3D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4℃时,100 mL水中溶解了 22.4 L HCl气体(标准状况下测得)后形成溶液。下列说法正确的是( )
A.该溶液物质的量浓度为10 mol/L
B.该溶液物质的量浓度因溶液的密度未知而无法求得
C.该溶液中溶质的质量分数因溶液的密度未知而无法求得
D.所得溶液的体积为22.5 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属镁,其流程如图所示:
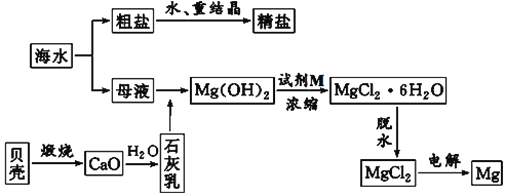
(1)海水提取镁要用到海滩上的贝壳,贝壳煅烧过程中发生反应的化学方程式为___________________________________________。
(2)母液中加入石灰乳反应的离子方程式为______。
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的。
溶解时:_____________________________,
过滤时:_____________________________,
蒸发时:_____________________________。
(4)除去粗盐溶液中含有的![]() 、
、![]() 、
、![]() ,可依次加入
,可依次加入![]() 溶液、NaOH溶液、________,最后加入_________调节pH至中性。
溶液、NaOH溶液、________,最后加入_________调节pH至中性。
(5)写出金属镁在空气中燃烧的化学方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识回答下列问题:
Ⅰ.丁腈橡胶(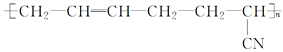 )具有优良的耐油、耐高温性能,合成丁腈橡胶的二种单体是_________________和_______________,是通过___________反应得到。
)具有优良的耐油、耐高温性能,合成丁腈橡胶的二种单体是_________________和_______________,是通过___________反应得到。
Ⅱ. 硅橡胶具有无毒,无味,耐高温又耐低温,可制成耐温垫圈,密封件和人造心脏,人造血管等,他是由单体二甲基二氯硅烷(CH3)2SiCl2水解得到二甲基硅二醇,经脱水缩聚成的聚硅氧烷再经交联制成的,请用化学方程式写出上述二甲基二氯硅烷水解及线性缩聚的方程式_________________和_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用25mL18.4mol/L的浓硫酸与铜共热一段时间后,冷却,过滤除去多余的铜,将滤液稀释到100 mL,所得溶液中SO42-浓度为3mol/L,则此时溶液中CuSO4的物质的量浓度为
A. 0.5mol/L B. 1.6 mol/L C. 1.8 mol/L D. 3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaC1O3和NaI按物质的量之比1:1混合于烧瓶中,滴入适量硫酸,并水浴加热,反应后测得NaC1O3和NaI恰好完全反应,生成I2、Na2SO4和H2O,并产生棕黄色的气体X,则X为
A. Cl2 B. Cl2O C. Cl2O3 D. ClO2
【答案】D
【解析】试题分析:根据转移电子数守恒得,1molNaI中的碘元素由-1价生成单质碘,化合价升高转移1mol电子,故NaClO3中的氯元素化合价降低转移1mol电子,故X气体中氯元素的价态为+4价,答案选D.
考点:氧化还原反应
【题型】单选题
【结束】
25
【题目】把4.48LCO2通过一定量的固体过氧化钠后收集到3.36L气体(气体的测量均在标准状况下),所得气体的总质量是
A. 3.2g B. 4.8g C. 5.4g D. 6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
I.现有下列10种物质①熔融的氢氧化钠 ②蔗糖 ③纯净的盐酸 ④金属钠 ⑤硫酸 ⑥二氧化硫 ⑦硫粉 ⑧石膏(CaSO4·2 H2O) ⑨酒精溶液 ⑩液氨
(1)属于电解质的有_____________________。
(2)属于非电解质的有_____。
(3)上述状态下能导电的有_____。
(4)上述状态下的电解质不能导电的有_____。
II.Fe(OH)2长时间露置于空气中发生变化的化学方程式为:___________________________。
偏铝酸钠溶液中通入足量二氧化碳反应的离子方程式为:____________________________。
III.高纯度单晶硅可以按下列方法制备:
![]()
写出步骤①的化学方程式________________________。
步骤②的产物经过冷凝后得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃),提纯SiHCl3主要操作的名称是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com