
【题目】常温下,将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的粒子浓度与溶液pH的变化关系如下图所示。下列叙述正确的是( )
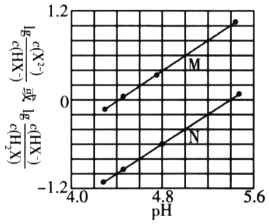
A. 曲线M表示![]() 与pH的变化关系
与pH的变化关系
B. NaHX溶液显碱性
C. 当混合溶液呈中性时,![]()
D. ![]() 的数量级为
的数量级为![]()
【答案】C
【解析】
H2X为二元弱酸,以第一步电离为主,则Ka1(H2X)>Ka2(H2X),酸性条件下,则pH相同时![]() >
> ![]() ,由图象可知N为lg
,由图象可知N为lg![]() 的变化曲线,M为lg
的变化曲线,M为lg![]() 的变化曲线,当lg
的变化曲线,当lg![]() 或lg
或lg![]() = 0时,说明
= 0时,说明![]() 或
或 ![]() =1,浓度相等,结合图象可计算电离常数的表达式并判断溶液的酸碱性。
=1,浓度相等,结合图象可计算电离常数的表达式并判断溶液的酸碱性。
A. 由以上分析可知曲线N表示pH与lg![]() 的变化关系,曲线M表示pH与lg
的变化关系,曲线M表示pH与lg![]() 的变化曲线,故A项错误;
的变化曲线,故A项错误;
B. 由图象可知,lg![]() = 0时,即
= 0时,即![]() =1,此时pH≈5.4,可知HX电离程度大于X2水解程度,则NaHX溶液呈酸性,故B项错误;
=1,此时pH≈5.4,可知HX电离程度大于X2水解程度,则NaHX溶液呈酸性,故B项错误;
C. 由图象可知当混合溶液呈中性时,lg![]() > 0,即c(X2)>c(HX),混合溶液的离子浓度大小关系为:c(Na+)>c(X2-)> c(HX-)> c(H+)=c(OH),故C项正确。
> 0,即c(X2)>c(HX),混合溶液的离子浓度大小关系为:c(Na+)>c(X2-)> c(HX-)> c(H+)=c(OH),故C项正确。
D. lg![]() = 0时,
= 0时,![]() =1,此时pH≈5.4,则Ka2(H2X)≈105.4,可知Ka2(H2X)的数量级为10-6,故D项错误;
=1,此时pH≈5.4,则Ka2(H2X)≈105.4,可知Ka2(H2X)的数量级为10-6,故D项错误;
答案选C。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. KClO3+6HC1=KCl+3C12↑+3H2O 中,生成13.44L (标准状况) C12转移电子数为1.2 NA
B. 标准状况下,22.4LC12通入足量水中转移电子数为NA
C. 足量的MnO2与一定量的浓盐酸反应得到1mol Cl2,若向反应后的溶液中加入足量的AgNO3,则生成AgC1的物质的量为2 mol
D. 5.6g Fe 与一定量的稀硝酸反应,转移电子数可能为0.26 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 溶液中,不断通入HCl气体
溶液中,不断通入HCl气体![]() 忽略溶液体积变化
忽略溶液体积变化![]() ,得到
,得到![]() 和
和![]() 与pH的变化关系如图所示,则下列说法不正确的是
与pH的变化关系如图所示,则下列说法不正确的是![]()
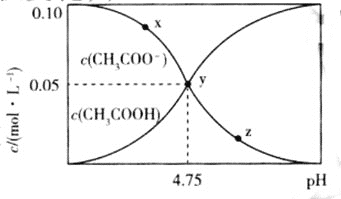
A.溶液中水的电离程度:![]()
B.在y点时,通入的HCl气体在标准状况下的体积为![]()
C.随着HCl的通入,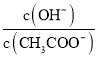 不断减小
不断减小
D.该温度下,![]() 的
的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,![]() 的
的![]() 溶液中,
溶液中,![]() 、
、![]() 、
、![]() 三者所占物质的量分数
三者所占物质的量分数![]() 分布系数
分布系数![]() 随pH变化的关系如图所示。下列表述不正确的是
随pH变化的关系如图所示。下列表述不正确的是
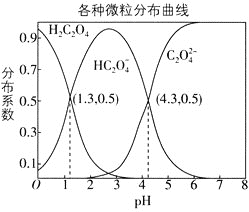
A.![]() 的平衡常数
的平衡常数![]()
B.将等物质的量的![]() 、
、![]() 溶于水中,所得溶液pH恰好为
溶于水中,所得溶液pH恰好为![]()
C.常温下HF的电离常数![]() ,将少量
,将少量![]() 溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
D.在![]() 溶液中,各离子浓度大小关系为
溶液中,各离子浓度大小关系为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=13的两种碱溶液M、N各1mL,分别加水稀释到1000mL,其pH与溶液体积(V/mL)的关系如图所示,下列说法正确的是( )
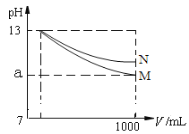
A.M、N两种碱溶液的物质的量浓度一定相等
B.稀释后,M溶液的碱性比N溶液强
C.若10<a<13,则M、N都是弱碱
D.若a=10,则M是强碱,N不一定是弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种优良的水处理剂。25℃,其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)=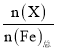 ]。下列说法正确的是( )
]。下列说法正确的是( )

A.K2FeO4、H2FeO4都属于强电解质
B.25℃,H2FeO4+H+![]() H3FeO4+的平衡常数K>100
H3FeO4+的平衡常数K>100
C.由B点数据可知,H2FeO4的第一步电离常数Ka1=4.15×10-4
D.A、C两点对应溶液中水的电离程度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,有
时,有![]() 的一组醋酸和醋酸钠的混合溶液,溶液中
的一组醋酸和醋酸钠的混合溶液,溶液中![]() 、
、![]() 与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是
与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是 ![]()
![]()

A.![]() 的溶液中:
的溶液中:![]()
B.该温度下醋酸的电离平衡常数为![]()
C.![]() 的溶液中:
的溶液中:![]()
D.向W点所表示的溶液中加入等体积的![]() 溶液:
溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]()
![]() 。某温度下,在容积为1L的密闭容器中充入1mol
。某温度下,在容积为1L的密闭容器中充入1mol![]() 和
和![]()
![]() ,在一定条件下反应,测得
,在一定条件下反应,测得![]() 、
、![]() 的物质的量随时间的变化关系如图所示。下列说法正确的是
的物质的量随时间的变化关系如图所示。下列说法正确的是
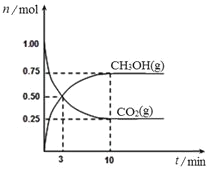
A.从反应开始到平衡,![]() 的平均反应速率
的平均反应速率![]()
![]()
B.此温度下,该反应的平衡常数为![]()
C.缩小体积,既能增大反应速率,又能提高![]() 的转化率
的转化率
D.欲增大平衡状态时![]() ,可采用升高温度的方法
,可采用升高温度的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)D﹣的结构示意图是___。
(2)C元素的气态氢化物的化学式为:___;其检验方法:___。
(3)B元素在周期表中的位置___;离子半径:B___A(填“大于”或“小于”)。
(4)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为___,与D的氢化物的水化物反应的离子方程式为___。
II.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

(1)NO的平衡浓度c/span>(NO)=___。
(2)图中表示NO2变化的曲线是___,用O2表示0~2s内该反应的平均速率υ=___。
(3)能说明该反应已达到平衡状态的是___。
a.υ(NO2)=2υ(O2) b.容器内气体压强保持不变
c.υ逆(NO)=2υ正(O2) d.容器内气体的密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com