
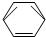
 -CH2CH3$\stackrel{酸性KMn_{4}O_{2}溶液}{→}$C6H5-COOH
-CH2CH3$\stackrel{酸性KMn_{4}O_{2}溶液}{→}$C6H5-COOH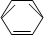 +HNO3 $→_{55~60℃}^{浓硫酸}$C6H5NO2 +H2O
+HNO3 $→_{55~60℃}^{浓硫酸}$C6H5NO2 +H2O分析 (1)丙烯与氯气发生加成反应生成CH3CHClCH2Cl;
(2)乙苯被酸性高锰酸钾氧化生成苯甲酸;
(3)苯与硝酸发生取代反应生成硝基苯和水;
(4)乙醇在浓硫酸催化剂作用下加热到170度发生消去反应生成乙烯和水.
解答 解:(1)丙烯与氯气发生加成反应生成CH3CHClCH2Cl,方程式:CH3CH=CH2+Cl2→CH3CHClCH2Cl,故答案为:Cl2;加成反应;
(2)乙苯被酸性高锰酸钾氧化生成苯甲酸,方程式:C6H5-C2H5$\stackrel{酸性高锰酸钾}{→}$C6H5-COOH,故答案为:C6H5-COOH;氧化反应;
(3)苯与硝酸发生取代反应生成硝基苯和水,方程式C6H6+HNO3$→_{50℃-60℃}^{浓硫酸}$C6H5NO2 +H2O,故答案为:C6H5NO2 ;H2O,取代反应;
(4)乙醇在浓硫酸催化剂作用下加热到170度发生消去反应生成乙烯和水,方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,故答案为:CH3CH2OH;消去反应.
点评 本题考查了有机化学方程式的书写解反应类型判断,明确有机物结构特点是解题关键,题目难度不大,注意反应条件的书写.


科目:高中化学 来源: 题型:选择题
| A. | 3,4-二甲基-4-乙基庚烷 | B. | 3,5-二甲基-3-庚烯 | ||
| C. | 3-乙基-1-辛烯 | D. | 2,4,4-三甲基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 | |
| B. | 碱金属元素中,锂原子失去最外层电子的能力最弱 | |
| C. | 钾与水的反应比钠与水的反应更剧烈 | |
| D. | 溴单质与水的反应比氯单质与水的反应更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
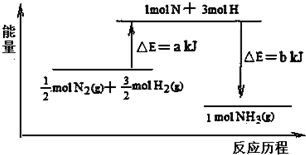
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
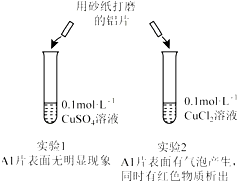
| A. | 由实验1 可以得出结论:金属铝的活泼性弱于金属铜 | |
| B. | 实验2 中生成红色物质的离子方程式:Al+Cu2+═Al3++Cu | |
| C. | 溶液中阴离子种类不同是导致实验1、2 出现不同现象的原因 | |
| D. | 由上述实验可推知:用砂纸打磨后的铝片分别与浓度均为0.2mol•L-1的盐酸和硫酸反应,后者更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数a>b>c>d | |
| B. | 离子半径D(n+1)->Cn->An+>B(n+1)+ | |
| C. | 单质还原性A>B>C>D | |
| D. | 最高价氧化物对应水化物的碱性B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验溶液中I-:取样→滴加氯水→再滴加淀粉溶液,溶液变蓝 | |
| B. | 检验溶液中的Fe2+:取样$\stackrel{KSCN溶液}{→}$无明显现象$\stackrel{KMnO_{4}}{→}$红色溶液 | |
| C. | 证明氧化性Fe3+>Cu2+:向FeCl3、CuCl2混合液中加入少量铁粉,无红色固体产生 | |
| D. | 配制0.5mol•L-1的CuSO4溶液:用天平称取12.5g CuSO4•5H2O配成100mL溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com