
【题目】化学学习中常用类推方法,下列类推正确的是![]()
A.![]() 为直线形分子,
为直线形分子,![]() 也为直线形分子
也为直线形分子
B.![]() 的沸点高于
的沸点高于![]() ,
,![]() 的沸点也高于
的沸点也高于![]()
C.![]() 中N原子是
中N原子是![]() 杂化,
杂化,![]() 中B原子也是
中B原子也是![]() 杂化
杂化
D.![]() 能溶于NaOH溶液,
能溶于NaOH溶液,![]() 也能溶于NaOH溶液
也能溶于NaOH溶液
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知t℃时AgCl的Ksp=2×10-10;在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
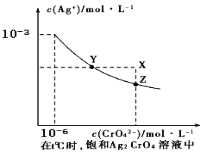
A. 在t℃时,Ag2CrO4的Ksp为1×10-9
B. 在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C. 在t℃时,以0.01 mol/L AgNO3溶液滴定20 mL0.01 mol/LKCl和0.01 mol/L的K2CrO4的混和溶液,Cl-先沉淀
D. 在t℃时,AgCl的溶解度大于Ag2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是一种强还原剂,用NaClO与NH3反应可用于生产肼(N2H4),其反应的化学方程式为:NaClO+2NH3= N2H4+NaCl+H2O。
⑴生产1000 g质量分数为25.6%的肼溶液最少需要___________L(标准状况)NH3。
⑵工业次氯酸钠溶液中含有氯酸钠会影响所得肼的产品质量。测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将次氯酸钠完全还原(ClO3-在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点(Cr2O72-被还原为Cr3+),消耗该溶液20.00 mL。
①用H2O2与次氯酸钠反应的离子方程式为___________。
②实验中加热煮沸的目的是___________。
③计算样品中NaClO3的含量(以g·L-1表示),写出计算过程。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠![]() 是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,
是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,![]() ,以木炭、浓硝酸、
,以木炭、浓硝酸、![]() 为主要原料制备亚硝酸钠的装置如图所示
为主要原料制备亚硝酸钠的装置如图所示![]() 部分夹持装置已略去
部分夹持装置已略去![]() 。下列说法正确的是( )
。下列说法正确的是( )
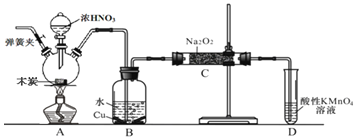
A.可以将B中药品换成NaOH溶液
B.应在B、C之间加一个盛放无水![]() 的干燥管
的干燥管
C.实验开始前先向装置中通入![]() ,实验结束时先停止通入
,实验结束时先停止通入![]() 再熄灭酒精灯
再熄灭酒精灯
D.装置D可用于尾气处理,标况下每吸收![]() L的尾气消耗
L的尾气消耗![]() mol高锰酸钾
mol高锰酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按照下列要求回答问题:
(1)电解氯化钠溶液的化学方程式:__________________________________。
(2)硫化钠水解的离子方程式:________________________________。
(3)0.1 mol/L 的碳酸钠溶液中离子浓度由大到小顺序为:__________________________。
(4)浓的 Al2(SO4)3 溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理__________________________。
(5)将25℃下 pH=12 的 Ba(OH)2 溶液aL与 pH=1的HCl溶液bL 混合,若所得混合液为中性,则 a:b= __________________________。(溶液体积变化忽略不计)。
(6)pH=3 的 NH4Cl 溶液,由水电离出的 c(H+)= __________________________。
(7)常温时,Fe(OH)3 的溶度积常数 Ksp=1×10-38,要使溶液中的 Fe3+沉淀完全(残留的 c(Fe3+)<10-5 mol·L-1),则 溶液的 pH 应大于____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中位于如图A、D位置的两种元素有很多相似的性质,如锂和镁、铍和铝,该规律被称为“对角线规则”。下列说法错误的是

A. 镁条存放可直接接触空气,但锂在实验室存放时不能直接接触空气
B. 铍的氧化物为两性
C. 锂和镁在空气中燃烧均不生成过氧化物
D. 氢氧化铍与氢氧化钠溶液反应会生成NaBeO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较中正确的是
A. 相同浓度的三种溶液:①(NH4)2CO3溶液、②NH4HCO3溶液、③NH4NO3溶液中 c(NH4+):③>①>②
B. 相同pH的溶液:①NaClO溶液、②NaHCO3溶液、③CH3COONa溶液中 c(Na+):③>②>①
C. 同浓度、同体积的溶液:①CH3COONa溶液、②NH4Cl溶液、③NaNO3溶液中 pH:②>③>①
D. 相同浓度的溶液:①氨水、②NaOH溶液、③Ba(OH)2溶液 c(H+):②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计一个电池(如下图所示),探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

(1)通入氢气的电极为________ (填正极或负极),该电极反应式为_______。
(2)石墨电极为________ (填阳极或阴极),乙中总反应离子方程式为________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将_________(填“增大”“减小”或“不变”)。
(4)若甲中消耗0.01molO2,丙中精铜增重_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与其用途完全符合的有多少条( )
![]() 光导纤维
光导纤维 ![]() 制玻璃
制玻璃 ![]() 红色油漆或涂料
红色油漆或涂料 ![]() 耐火材料
耐火材料 ![]() 消毒剂
消毒剂 ![]() 制纯碱
制纯碱![]() 食品漂白剂
食品漂白剂![]() 焊接钢轨
焊接钢轨![]() 制冷剂.
制冷剂.![]() 人工降雨
人工降雨
A.6B.7C.5D.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com