
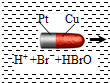
 一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为:Cu+Br2=CuBr2.下列说法正确的是( )
一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为:Cu+Br2=CuBr2.下列说法正确的是( )| A. | 铜为电池的正极 | |
| B. | 铂不断溶解 | |
| C. | 稀溴水为电解质溶液 | |
| D. | 电池工作时实现机械能向电能再向化学能转化 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯分子中含碳碳双键 | |
| B. | 以淀粉为原料可制取乙酸乙酯 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 油脂的皂化反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
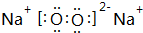 ,7.8g该化合物与足量的CO2反应,转移电子数目为6.02×1022,固体增重为2.8g.
,7.8g该化合物与足量的CO2反应,转移电子数目为6.02×1022,固体增重为2.8g.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
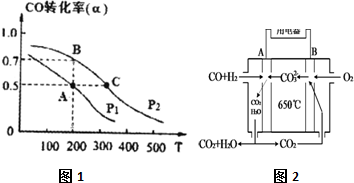
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (m-0.1)g | B. | (m-0.8)g | C. | (m-1.2)g | D. | (m-1.6)g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
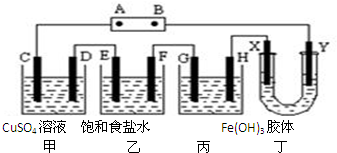 将下列装置如图连接,D、F、X、Y、E 都是铂电极,C是铁电极.甲,乙,丙三个装置中电解前后溶液的体积都是500mL.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.下列说法不正确的是( )
将下列装置如图连接,D、F、X、Y、E 都是铂电极,C是铁电极.甲,乙,丙三个装置中电解前后溶液的体积都是500mL.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.下列说法不正确的是( )| A. | 电源B 极的名称是负极,丁中Y极附近颜色变深 | |
| B. | 乙装置中电解一段时间后,加入0.2mol盐酸则可以恢复原来的浓度 | |
| C. | 设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为0.2mol/L | |
| D. | 甲装置中电解反应的总化学方程式是:CuSO4+Fe$\frac{\underline{\;电解\;}}{\;}$Cu+FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
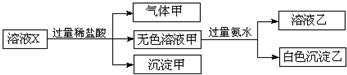 水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子.某同学对该溶液进行了如图实验:下列判断正确的是( )
水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子.某同学对该溶液进行了如图实验:下列判断正确的是( )| A. | 沉淀甲不一定是纯净物 | |
| B. | 溶液中一定有Al3+和CO32-和SiO32- | |
| C. | K+、AlO2-和SiO32-一定存在于溶液X中 | |
| D. | CO32-和SO42-一定不存在于溶液X中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性 | |
| B. | 用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度 | |
| C. | 用水可以鉴别乙醇、甲苯和溴苯 | |
| D. | 用酸性高锰酸钾溶液可以鉴别苯、环已烯和环已烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com