
 ���÷�Ӧ�л�ԭ����KI��21.4g KIO3�μӷ�Ӧʱת�Ƶ���0.5mol��
���÷�Ӧ�л�ԭ����KI��21.4g KIO3�μӷ�Ӧʱת�Ƶ���0.5mol������ ��1������������ԭ��Ӧ�л��ϼ۵���������������ת��������⻯���е�Ԫ�صĻ��ϼ������ǻ�ԭ�������ݻ��ϼ۵ı仯������������ӵ�ת�Ƶ����ʵ�����
��2������I2��K2SO4��Һ����ȡ�ķ���������ȡˮ��Һ�еĵⵥ�ʣ����������Ȼ�̼����ȡ����
��3������ϡ�Ͷ���CŨVŨ=CϡVϡ�����㣻��������һ�����ʵ���Ũ�ȵ���Һ�IJ����ǣ����㡢��ȡ��ϡ�͡���Һ��ϴ�ӡ����ݡ�ҡ����ѡ��ʹ�õ�������
��4������c=$\frac{n}{V}$��ͨ���жϲ������������ʵ����ʵ���n����Һ���V��Ӱ����������
��� �⣺��1����ӦKIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4�з�Ӧ�е���1molKIO3��Ӧʱ��ת��5mol���ӣ�����˫���ű�ʾ�÷�Ӧ�е���ת�Ƶķ������ĿΪ�� ���⻯���е�Ԫ�صĻ��ϼ������ǻ�ԭ������Ӧ�е���1molKIO3��Ӧʱ��ת��5mol���ӣ��ʵ�21.4g��0.1mol KIO3�μӷ�Ӧʱת�Ƶ���0.5mol��
���⻯���е�Ԫ�صĻ��ϼ������ǻ�ԭ������Ӧ�е���1molKIO3��Ӧʱ��ת��5mol���ӣ��ʵ�21.4g��0.1mol KIO3�μӷ�Ӧʱת�Ƶ���0.5mol��
�ʴ�Ϊ�� ��KI��0.5��
��KI��0.5��
��2��I2���л��ܼ��е��ܽ�ȴ�����ˮ�е��ܽ�ȣ��ʽ�I2��K2SO4��Һ�з��룬Ӧ��ȡ��ȡ��Һ�ķ��������룬ʹ�õ���Ҫ�����Ƿ�Һ©����ѡ�õ���ȡ����Ӧͬʱ��������Ҫ�ⵥ������ȡ���е��ܽ�ȴ�����ˮ�е��ܽ�ȣ���ȡ����ˮ�������ܣ����ʡ���ȡ����ˮ���以����Ӧ����Ӧѡ���Ȼ�̼����ȡ���������Ȼ�̼���ܶȱ�ˮ�ʷ�Һ�������Ȼ�̼��Һ���²㣬���Ϻ�ɫ��
�ʴ�Ϊ��C����ȡ��Һ����Һ©�����ձ������÷ֲ���²���ҺΪ�Ϻ�ɫ��˵���е⣻��3������Ҫ��Ũ��������ΪVmL��������Һ��ϡ�Ͷ��ɿ�֪��0.5mol/L��0.5L��98g/mol=1.84g/cm3��VmL��98%����ã�V=13.6mL��
����һ�����ʵ���Ũ�ȵ���Һ�IJ����ǣ����㡢��ȡ��ϡ�͡���Һ��ϴ�ӡ����ݡ�ҡ�ȿ�֪ѡ�õ�������50mL��Ͳ���ձ�����������500mL����ƿ�ͽ�ͷ�ιܣ���ѡCEFGH���ʴ�Ϊ��13.6��CEFGH��
��4��A���ܽ����Һû����ȴ�����¾�ת�ƣ�����ȴ����Һ���ƫС����Ũ��ƫ�ߣ���Aѡ��
B��ת��ʱû��ϴ���ձ�������������������ʵ���ʧ����Ũ��ƫ�ͣ���B��ѡ��
C��������ƿ��ˮ����ʱ�۾�����Һ�棬����Һ���ƫС����Ũ��ƫ�ߣ���Cѡ��
D������Ͳ��ȡŨ�����ϴ����Ͳ����ϴ��Һ����ת�Ƶ�����ƿ�У���������ƫ�࣬��Ũ��ƫ�ߣ���Dѡ��
E��ҡ�Ⱥ���Һ����ڿ̶����������ģ��ּ�����ˮ���̶���������Ũ��ƫ�ͣ���E��ѡ��
��ѡACD��
���� ���⿼����һ�����ʵ���Ũ�ȵ���Һ�����ù����е��������Լ�������ѡ�ã��ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������������Ӱ�����ǵ�����ͽ�����������Ҫ��Ⱦ��Ϊ�����������PM2.5������Ҫ��ԴΪȼú��������β���ȣ���˸�����Դ�ṹ���������ŵȴ�ʩ����Ч����PM2.5��SO2��NOx����Ⱦ��
������������Ӱ�����ǵ�����ͽ�����������Ҫ��Ⱦ��Ϊ�����������PM2.5������Ҫ��ԴΪȼú��������β���ȣ���˸�����Դ�ṹ���������ŵȴ�ʩ����Ч����PM2.5��SO2��NOx����Ⱦ��| ���� | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| Ũ��mol/L | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
| ���� �¶�/�� | ����̿ | NO | E | F |
| ��ʼ | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
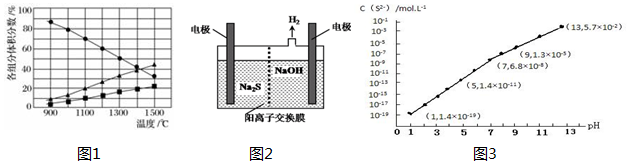
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����


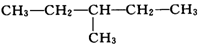
| A�� | �٢ں͢� | B�� | �ڢۺ͢� | C�� | �ٺ͢� | D�� | �ܺ͢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
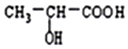
| A�� | �÷�ӦΪ�ӳɷ�Ӧ��û�и��������� | |
| B�� | ����Br2/CCl4��Һ�����ϩ������� | |
| C�� | ��ϩ�������ᶼ�����л��ᣬ���߲�������Ӧ | |
| D�� | 1mol����ֱ�������Na��NaOH��NaHCO3��Ӧ�������������ʵ���֮��Ϊ2��2��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | OH- | B�� | CO32- | C�� | Ag+ | D�� | Mg2+ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com