
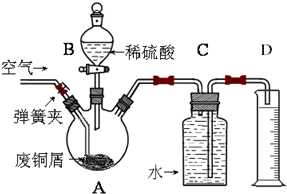
分析 (1)A中的废铜屑含有铁加入稀硫酸反应生成氢气,装置C是排水量气装置;
(2)①拆除C、D装置后,打开弹簧夹,持续将空气通入A中,至A中固体全部消失,再继续通入一段时间空气后,关闭弹簧夹,停止通入空气;
②依据酸性环境下氧气能够氧化二价铁离子生成三价铁离子,三价铁离子能够与铜反应生成铜离子与二价铁离子;
③加快A中的固体溶解速率增大,可以依据影响反应速率的因素分析;
(3)将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液,依据反应现象和反应物和产物分析书写离子方程式;
(4)测定沉淀质量计算铁元素质量来计算得到铜的质量分数.
解答 解:(1)A中的废铜屑含有铁加入稀硫酸反应生成氢气,装置C是排水量气装置,现象是C中液面下降,水被排到D中;
故答案为:水面下降,水顺长导管排入D中;
(2)①拆除C、D装置后,为了使A中固体全部消失,打开弹簧夹,持续将空气通入A中;
故答案为:打开弹簧夹,持续将空气通入A中;
②拆除C、D装置后,打开弹簧夹,持续将空气通入A中,生成的亚铁离子被空气中 的氧气氧化为铁离子,反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,
铁离子和铜反应生成亚铁离子,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;
故答案为:4Fe2++O2+4H+=4Fe3++2H2O,2Fe3++Cu=2Fe2++Cu2+;
③为使A中固体加快溶解速率,
a.对A装置加热,温度升高会加快反应速率,故a正确;
b.向A内加入少量Fe2O3,溶解后自动铁离子浓度会提高溶解铜的反应速率,故b正确;
c.向A内加入少量CuO,和硫酸反应不能加快溶解速率,故c错误;
d.增大空气通入量,自动氧气浓度可以提高反应速率,故d正确;
e.向A内加入少量FeSO4,增大了亚铁离子浓度能加快反应速率,故e正确;
f.向A内加入少量H2O,稀释溶液浓度,反应速率减小,故f错误;
故答案为:abde;
(3)将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液,此过程离子反应方程式是:Cu2(OH)2CO3+H++Fe3+=2Cu2++Fe(OH)3↓+CO2↑,
故答案为:Cu2(OH)2CO3+H++Fe3+=2Cu2++Fe(OH)3↓+CO2↑;
(4)不用测量气体法,可以依据沉淀方法,测定沉淀氢氧化铁质量,计算铁元素质量,得到铜的质量,计算废铜屑中铜的质量百分含量,沉淀实验方法为:将得到的氢氧化铁沉淀洗涤、干燥、称量、计算,
故答案为:将(4)中所得红褐色沉淀洗涤、干燥、称量、计算.
点评 本题考查探究物质组成的实验,题目难度中等,明确常见物质的性质是解题关键,注意影响反应速率的因素,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
 某同学设计实验以探究元素性质的递变规律,实验装置如图所示.
某同学设计实验以探究元素性质的递变规律,实验装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着碳原子数的增多,一氯代烃的沸点逐渐升高 | |
| B. | 随着碳原子数的增多,一氯代烃的密度逐渐增大 | |
| C. | 等碳原子数的一氯代烃,支链越多,沸点越低 | |
| D. | 等碳原子数的一卤代烃,卤素的原子序数越大,沸点越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:在酸性条件下发生的反应为AsO43-+2I-+2H+═AsO33-+I2+H2O,在碱性条件下发 生的反应为AsO33-+I2+2OH-═AsO43-+H2O+2I-. 设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
已知:在酸性条件下发生的反应为AsO43-+2I-+2H+═AsO33-+I2+H2O,在碱性条件下发 生的反应为AsO33-+I2+2OH-═AsO43-+H2O+2I-. 设计如图装置(C1、C2均为石墨电极),分别进行下述操作:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应的实质是化合价变化 | |
| B. | 具有氧化性的物质在反应中一定做氧化剂 | |
| C. | 氧化剂氧化其他物质时,本身被还原 | |
| D. | 还原剂在反应中本身被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.4g D2气体分子含有的中子数小于0.2NA | |
| B. | 含有0.32g氧元素的二氧化硅中含有的硅氧键数目为0.02NA | |
| C. | 11.2L Cl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA | |
| D. | 7.8g过氧化钠粉末与足量二氧化硫反应转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉能产生氢气的溶液:Mg2+、K+、Br-、HCO3- | |
| B. | 滴入石蕊显红色的溶液:Na+、K+、S2-、NO3- | |
| C. | pH=14的溶液中:Na+、AlO2-、SO42-、Cl- | |
| D. | 滴入KSCN溶液显红色的溶液中:Ca2+、H+、I-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com